
| 选项 | 实验方案 | 观察要点 |
| A | 等浓度的醋酸与氢氧化钠溶液反应 | 恰好反应时的体积比 |
| B | 醋酸溶液中加入醋酸钠固体 | 溶液pH的变化 |
| C | 等体积等浓度的盐酸和醋酸分别和等量镁条反应 | 产生H2的起始速率 |
| D | 将pH=4的醋酸稀释成PH=6的溶液 | 加H2O的量 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、酸碱中和反应,无法判断电解质的强弱,不能作为区分电解质强弱;
B、醋酸溶液中存在电离平衡,引进醋酸跟后,影响平衡;
C、溶液中弱电解质部分电离,强电解质完全电离,c(H+)不同;
D、强电解质稀释,溶液中的n(H+),弱电解质稀释时,n(H+)增大.
解答 解:A、等浓度的醋酸与氢氧化钠溶液反应,属于酸碱中和反应,无法作为判断强弱电解质的依据,故A符合;
B、醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,加入醋酸钠固体后,平衡向着逆向移动,c(H+)减小,PH增大,B说法正确,故B不符合;
C、等体积等浓度的盐酸和醋酸,n(CH3COOH )=n(HCl),醋酸的弱电解质,部分电离,醋酸溶液中c(H+)要小于盐酸的,产生H2的起始速率会不同,C的判断正确,故C不符合;
D、弱电解质加水稀释,会促进电离,导致n(H+)增大,加入水的量要比强电解质多,D说法正确,故D不符合.
故选A.
点评 本题考查了弱电解质的电离,根据现象推断电解质强弱,主要是电离平衡的存在证明,题目难度中等.


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| T | 最外层电子数是电子层数的2倍 |
| Z | 元素最高正价是+7价 |
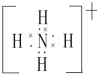 (用元素符号表示).
(用元素符号表示).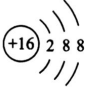 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
| B | 乙烷(乙烯) | 氢气 | 加热 |
| C | 溴(水) | 乙醇 | 蒸馏 |
| D | 乙醇(水) | 新制生石灰 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在饱和硫酸铜溶液中放入胆矾晶体,几天后晶体外形发生改变且晶体质量变小 | |
| B. | 将两块未擦去氧化膜的铝片分别投入1mol?L-1CuSO4溶液和1mol?L-1CuCl2溶液中,铝片表面都观察不到明显的反应现象 | |
| C. | 可用紫外可见分光光度法来测定溶液中苯酚的含量 | |
| D. | 在比较乙醇和苯酚与钠反应的实验中,要把乙醇和苯酚配成同物质的量浓度的水溶液,再与相同大小的金属钠反应,来判断两者羟基上氢的活性大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、HSO3-、Cl- | B. | H+、Al3+、Fe3+、I- | ||
| C. | NH4+、K+、Cl-、NO3- | D. | Na+、Ba2+、AlO2-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
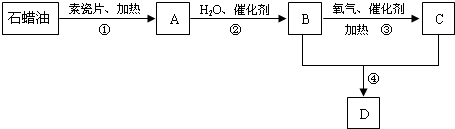
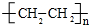 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C | B. | N | C. | Si | D. | Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
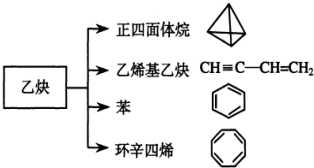

 、
、
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com