
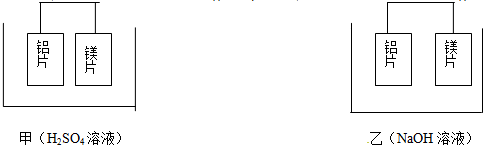
分析 (1)甲中镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应;
(2)乙池中铝易失电子作负极、镁作正极,负极上铝失电子发生氧化反应;
(3)根据作负极的金属活泼性强结合电池中的负极判断;
(4)A.原电池正负极与电解质溶液有关;
B.镁的金属性大于铝;
C.该实验证明说明电解质溶液性质选用选择合适的介质,不能说明金属活动性顺序过时;
D.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析;
(5)①原电池中失电子的一极为负极,据此进行判断;
②插入浓硝酸中形成原电池反应为:铜与浓硝酸反应生成硝酸铜、二氧化氮气体和水.
解答 解:(1)甲中镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应,负极反应为Mg-2e-=Mg2+,正极反应为2H++2e-=H2↑,
故答案为:Mg-2e-=Mg2+;2H++2e-=H2↑;
(2)乙池中铝易失电子作负极,负极上铝失电子发生氧化反应,电极反应式为:Al+4OH--3e-=AlO2-+2H2O,镁作正极,正极发生还原反应,总反应为2Al+2OH-+2H2O=AlO2-+3H2↑,
故答案为:Al+4OH--3e-=AlO2-+2H2O;2Al+2OH-+2H2O=AlO2-+3H2↑;
(3)甲中镁作负极、乙中铝作负极,根据作负极的金属活泼性强判断,甲中镁活动性强、乙中铝活动性强,
故答案为:Mg;Al;
(4)A.根据甲、乙中电极反应式知,原电池正负极与电解质溶液有关,故A正确;
B.镁的金属性大于铝,但失电子难易程度与电解质溶液有关,故B错误;
C.该实验说明电解质溶液性质影响电极的正负极,不能说明金属活动性顺序没有使用价值,故C错误;
D.该实验说明化学研究对象复杂,反应与条件有关,电极材料相同其反应条件不同导致其产物不同,所以应具体问题具体分析,故D正确;
故答案为:AD;
(5)①铝片和铜片插入浓HNO3溶液中,金属铝会钝化,金属铜和浓硝酸之间会发生自发的氧化还原反应,此时金属铜时负极,金属铝是正极;
插入稀NaOH溶液中,金属铜和它不反应,金属铝能和氢氧化钠发生自发的氧化还原反应,此时金属铝是负极,金属铜是正极;
故答案为:B;
②插入浓硝酸中形成原电池中,总反应为铜与浓硝酸反应生成硝酸铜、二氧化氮和水,即:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.
点评 本题考查了探究原电池原理,题目难度中等,明确原电池中各个电极上发生的反应是解本题关键,注意不能根据金属的活动性强弱判断正负极,要根据失电子难易程度确定负极,为易错点.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
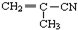 ②
②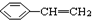 ③
③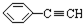 ④CH3-CH=CH-CN ⑤CH2=CH-CH=CH2,其中可用于合成高分子材料(结构如图所示)的正确组合为( )
④CH3-CH=CH-CN ⑤CH2=CH-CH=CH2,其中可用于合成高分子材料(结构如图所示)的正确组合为( )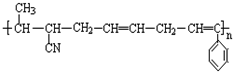
| A. | ①②④ | B. | ①②⑤ | C. | ②④⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醛、乙酸 | B. | 甲酸乙酯、丙酸 | ||
| C. | CH3CH2CHO、CH3COCH3 | D. | CH3CH2CH2OH、CH3OCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知某可逆反应mA(g)+nB(g)?qC(g)△H在密闭容器中进行.如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况.下列推断中正确的是( )
已知某可逆反应mA(g)+nB(g)?qC(g)△H在密闭容器中进行.如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况.下列推断中正确的是( )| A. | p1>p2,T1<T2,m+n>q,△H<0 | B. | p1<p2,T1>T2,m+n>q,△H>0 | ||
| C. | p1>p2,T1<T2,m+n<q,△H<0 | D. | p1<p2,T1>T2,m+n<q,△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解一定浓度的硫酸铜溶液,一段时间后,加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移电子数为0.4mol | |
| B. | 磷酸的电离方程式为:H3PO4=H++H2PO4- | |
| C. | 电镀时保持电流恒定,升温可知加快反应速率 | |
| D. | 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫 | B. | 碳 | C. | 氮 | D. | 硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
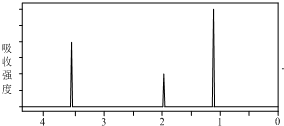
| A. | X只含C、H两种元素 | |
| B. | X含三种元素,其原子数之比为1:2:3 | |
| C. | 无法确定有机物X的分子式与结构式 | |
| D. | X的结构简式为CH3CH2OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com