
分析 X、Y、Z、W、T五种短周期元素,X元素原子最外电子数是次外层电子数的2倍,则X原子有2个电子层,最外层电子数为4,则X为碳元素;Y元素常温下单质为双原子分子,其氢化物的水溶液呈碱性,则Y为氮元素;Z元素最高正化合价是+7,最外层电子数为7,则Z为Cl元素;W是地壳中含量最多的金属元素,则W为Al;T原子的M层上有6个2电子,则T有3个电子层,最外层电子数为6,则T为S元素,据此解答.
解答 解:X、Y、Z、W、T五种短周期元素,X元素原子最外电子数是次外层电子数的2倍,则X原子有2个电子层,最外层电子数为4,则X为碳元素;Y元素常温下单质为双原子分子,其氢化物的水溶液呈碱性,则Y为氮元素;Z元素最高正化合价是+7,最外层电子数为7,则Z为Cl元素;W是地壳中含量最多的金属元素,则W为Al;T原子的M层上有6个2电子,则T有3个电子层,最外层电子数为6,则T为S元素.
(1)碳元素的一种同位素可测定文物年代,这种同位素的符号是614C,故答案为:614C;
(2)元素Y与氢元素形成一种离子NH4+,溶液中含有该微粒的检验方法:取适量溶液放入试管中,向试管中加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则可证明溶液中含NH4+,
故答案为:取适量溶液放入试管中,向试管中加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则可证明溶液中含NH4+;
(3)元素Z为Cl,在周期表中的位置是:第三周期第ⅦA族,实验室制备氯气的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
同周期自左而右非金属性减弱,故Cl元素非金属性较强,
a.氢化物酸性不能说明元素非金属性强弱,若HF为弱酸、HCl为强酸,故a错误;
b.氢化物越稳定,中心元素的非金属性越强,故b正确;
c.一定条件下,氯气能将硫离子从溶液中置换出来,可以说明Cl元素非金属性较强,故c正确,
故答案为:第三周期第ⅦA族; MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;Cl;bc;
(4)T、X、Y、Z四种元素的最高价氧化物对应水化物分别为H2SO4、H2CO3、HNO3、HClO4,H2CO3是弱酸,其余均为强酸,W最高价氧化物对应水化物为Al(OH)3,与硫酸反应离子方程式为:3H++Al(OH)3=Al3++3H2O,
故答案为:H2CO3;3H++Al(OH)3=Al3++3H2O;
(5)X形成的最简单有机物为CH4,与氯气在光照条件下反应的第一步方程式:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl,
故答案为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl.
点评 本题考查结构性质位置关系,难度不大,推断元素是解题关键,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 硝酸铵和水 | B. | 浓硫酸和水 | C. | 生石灰和水 | D. | 苛性钠和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2 | B. | 4:3 | C. | 1:1 | D. | 8:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
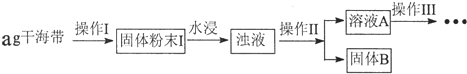
| 序号 | 实验操作 | 实验现象 | 结论 |
| ① | 取少量稀释后的溶液A加入淀粉后再用硫酸酸化,分装于试管Ⅰ、Ⅱ | 无现象 | |
| ② | 往试管I中加入FeCl2溶液,后加入2滴KSCN溶液并振荡; | 无现象 | 证明不是以IO3-形式存在 |
| ③ | 往试管II中加入3%H2O2溶液并振荡 | 溶液变蓝 | 证明以I-形式存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的相对原子质量 | B. | 原子的核内中子数 | ||
| C. | 原子的次外层电子数 | D. | 原子的电子层数和最外层电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同样多 | B. | HCl最多 | C. | HCl、HNO3一样多 | D. | CH3COOH最少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:b>a>c>d | B. | 原子半径:A>B>C>D | ||
| C. | 金属性:B>A,非金属性:D>C | D. | 离子半径:D>C>B>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol羟基与17g NH3所含电子数都为10NA | |
| B. | 1molCl2溶于水的过程中有NA个电子转移 | |
| C. | 1molC(金刚石)中σ 键的数目为2NA | |
| D. | 适量铜粉溶解于1L 0.5 mol/L稀硝酸中,当生成2.24L NO时,溶液中氮原子数为0.4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com