
| A. | Zn与稀H2SO4反应:Zn+H+═Zn2++H2↑ | |
| B. | Na2CO3溶液与足量盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| C. | Cl2与NaOH溶液反应:Cl2+2OH-═2Cl-+H2O | |
| D. | MgCl2溶液与过量氨水反应:Mg2++2OH-═Mg(OH)2↓ |
分析 A.电荷不守恒;
B.反应生成氯化钠、水、二氧化碳;
C.反应生成氯化钠、次氯酸钠和水;
D.一水合氨在离子反应中保留化学式.
解答 解:A.Zn与稀H2SO4反应的离子反应为Zn+2H+═Zn2++H2↑,故A错误;
B.Na2CO3溶液与足量盐酸反应的离子反应为CO32-+2H+═H2O+CO2↑,故B正确;
C.Cl2与NaOH溶液反应的离子反应为Cl2+2OH-═Cl-+ClO-+H2O,故C错误;
D.MgCl2溶液与过量氨水反应的离子反应为Mg2++2NH3.H2O═Mg(OH)2↓+2NH4+,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电解饱和食盐水制取氯气和烧碱(氯碱工业)
电解饱和食盐水制取氯气和烧碱(氯碱工业)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. | 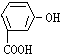 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 单质的颜色逐渐加深 | B. | 气态氢化物的稳定性逐渐增强 | ||
| C. | 单质的熔点逐渐升高 | D. | 单质的氧化性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.6g | B. | 4.1g | C. | 6.9 g | D. | 9.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
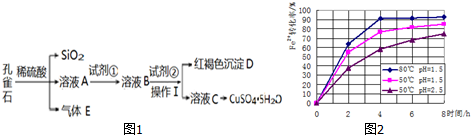
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀时的pH | 2.2 | 7.6 | 4.7 |
| 完全沉淀时的pH | 3.2 | 9.6 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com