
【题目】下列说法正确的是( )
A.CH4和C15H32为同系物
B.分子式为C4H8BrCl的有机物共有11种(不含立体异构)
C.化合物![]() (b)、
(b)、![]() (d)、正戊烷(p)中只有b的所有碳原子可能处于同一平面
(d)、正戊烷(p)中只有b的所有碳原子可能处于同一平面
D.CH3CH=CHCH3分子中的四个碳原子在同一直线上
【答案】A
【解析】
A.CH4和C15H32都属于烷烃,分子式不同,互为同系物,选项A正确;
B.C4H8BrCl可以看作C4H10中2个H原子被Cl、Br原子取代,而丁烷有CH3CH2CH2CH3、CH3CH(CH3)2两种,先分析碳骨架异构,分别为 C-C-C-C 与![]() 2种情况,然后分别对2 种碳骨架采用“定一移一”的方法分析,其中骨架 C-C-C-C 有
2种情况,然后分别对2 种碳骨架采用“定一移一”的方法分析,其中骨架 C-C-C-C 有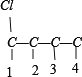 、
、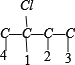 共 8 种,骨架
共 8 种,骨架![]() 有
有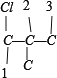 、
、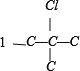 ,共 4 种,总共12种,选项B错误;
,共 4 种,总共12种,选项B错误;
C.![]() (d)、正戊烷(p)都含有饱和碳原子,具有甲烷的结构特点,则
(d)、正戊烷(p)都含有饱和碳原子,具有甲烷的结构特点,则![]() (d)、正戊烷(p)所有原子不可能处于同一平面,只有
(d)、正戊烷(p)所有原子不可能处于同一平面,只有![]() (b)为平面形结构,选项C错误;
(b)为平面形结构,选项C错误;
D.CH3CH=CHCH3分子中的四个碳原子和乙烯分子中4个氢原子两个碳原子结构相似为平面结构,四个碳原子不在同一直线上,选项D错误;
答案选A。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】实验室要用18mol/L 浓硫酸配制100 mL 3.0mol/L 稀硫酸,请回答下列问题:
(1)所需浓硫酸的体积是________;量取浓硫酸所用的量筒的规格是_________(填选项代号)
A. 10mL B. 20mL C. 50mL D. 100mL
(2)实验操作步骤为:
A.把制得的溶液小心地转移至容量瓶中。
B.量取所需浓硫酸 ,在烧杯中用适量的蒸馏水将它稀释并冷却至室温。
C.继续向容量瓶中加蒸馏水至液面距刻度1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。
E.将容量瓶塞塞紧,充分摇匀。
操作步骤的正确顺序为___________________(填序号)。
(3)下列情况中,会使所配溶液浓度偏高的是___________(填序号)。
A.量取所需浓硫酸某同学观察液面时仰视
B.没有进行上述的操作步骤D
C.加蒸馏水时,不慎超过了刻度线
D.容量瓶使用前内壁沾有水珠
E.用少量蒸馏水洗涤量取浓硫酸后的量筒,洗涤的液体注入容量瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组设计“全氢电池”如图中甲池(其中a、b为多孔石墨电极),拟用该电池电解处理生活污水,达到絮凝净化的目的。其工作原理示意图:
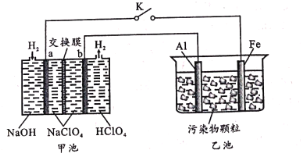
闭合K工作过程中,下列分析错误的是
A.甲池中a极反应为:H2-2e-+2OH-=2H2O
B.乙池中Fe电极区附近pH增大
C.一段时间后,乙池的两极间出现污染物颗粒沉降现象
D.如果Al电极上附着较多白色物质,甲池中Na+经过交换膜速率定会加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往FeBr2溶液中通入Cl2时,随参加反应Cl2物质的量的变化,溶液中某些离子的浓度变化情况如图所示。下列说法正确的是
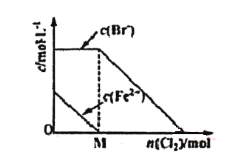
A. 当n(Cl2)<M mol时,发生的离子反应:2Br-+Cl2=Br2+2Cl-
B. 当n(Cl2)=M mol时,离子浓度关系:c(Fe3+):c(Br-):c(Cl-)=2:1:1
C. 当n(Cl2)=2M mol时,离子浓度大小关系:c(Cl-)>c(Br-)
D. 当Br-开始被氧化时,通入Cl2的物质的量大于原FeBr2的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈是稀土中丰度最高的元素,其在电子材料、催化剂等方面的应用广泛。现以氟碳铈矿(含CeFCO3、BaO、SiO2等)为原料制备氧化铈(CeO2),并测定其纯度。其工艺流程如下:

已知:①稀土离子易和SO![]() 形成复盐沉淀:
形成复盐沉淀:
Ce2(SO4)3+Na2SO4+nH2O==== Ce2(SO4)3·Na2SO4·nH2O↓(复盐沉淀);
②硫脲:一种有机物,结构简式为![]() ,酸性条件下易被氧化为(SCN2H3)2;
,酸性条件下易被氧化为(SCN2H3)2;
③Ce3+在空气中易被氧化为Ce4+;
回答下列问题:
(1)焙烧时,为了提高焙烧效率,可采取的措施有________________________________________
(2)CeFCO3中Ce元素的化合价为___________,滤渣A的主要成分是_____________
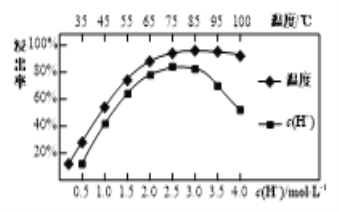
(3)焙烧后加入硫酸浸出,稀土的浸出率和硫酸浓度、温度有关,如图所示,应选择的适宜的条件为___________,硫酸浓度过大时,浸出率减小的原因是__________。
(4)加入硫脲的目的是将Ce4+还原为Ce3+,反应的化学方程式为_________。
(5)步骤③加入盐酸后,通常还需加入H2O2,其主要目的为_________。
(6)步骤④的离子方程式为________________________。
(7)取所得产品CeO2 8.0g,用30 mL高氯酸和20 mL磷酸混合液加热溶解,冷却至室温后,配成250 mL溶液。取25.00 mL溶液用0.2000 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,已知滴定时发生的反应为Fe2++Ce4+==== Fe3++Ce3+,达到滴定终点时消耗硫酸亚铁铵溶液20.50 mL,则该产品的纯度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A. 常温常压下,11.2L二氧化硫所含的氧原子数等于NA
B. 0.5molH2O所含的电子数为9NA
C. 8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA
D. 300mL2mol·L-1蔗糖溶液中所含分子数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温25 ℃下,向一定量的0.1 mol·L-1的BOH溶液中逐滴滴入稀盐酸。溶液中水电离出的氢离子浓度的负对数[用pC表示,pC=-lgc(H+)水]与加入盐酸体积的关系如图所示。下列叙述错误的是( )
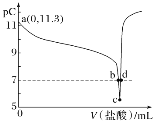
A.BOH为弱碱且Kb的数量级为10-5
B.b点溶液中:c(B+)=c(Cl-)
C.c点溶液中水的电离程度最大
D.c~d点间溶液中:c(BOH)+c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色环保水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,应用广泛。工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应氧化产物是_____(填化学式)。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO、OH、FeO42-、Cl、H2O。
①写出并配平碱性条件下湿法制高铁酸钾的离子反应方程式:________________________________。
②每生成1molFeO42-转移________mol电子;若反应过程中转移了0.3mol电子,则还原产物的物质的量为________mol。
Ⅱ.氧化还原反应在生产生活中应用广泛,思考回答以下问题
已知:2Fe3++2I===2Fe2++I2,2Fe2++Br2===2Fe3++2Br,2Fe2++Cl2===2Fe3++2Cl
(1)含有1mol FeI2和2mol FeBr2的溶液中通入2mol Cl2,此时被氧化的离子是________。
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c molCl2,当Br被氧化一半时,c为_______________(用含a、b的代数式表示)。
(3)已知:S2O![]() 具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2S2O32-→2I+S4O62-,S2O82-+2I→2SO42-+I2,则S2O82-、S4O62-、I2氧化性强弱顺序为:____________。
具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2S2O32-→2I+S4O62-,S2O82-+2I→2SO42-+I2,则S2O82-、S4O62-、I2氧化性强弱顺序为:____________。
(4)已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-;向含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如下图所示。
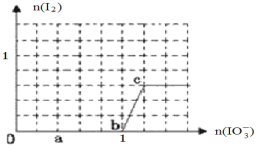
写出a点处还原产物是_______________;b点到c点反应的离子方程式________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池(如图)工作时,下列叙述正确的是( )
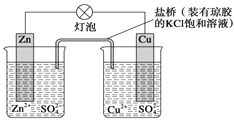
A. 正极反应为Zn-2e-==Zn2+
B. 电池反应为Zn+Cu2+==Zn2++Cu
C. 盐桥中的K+移向ZnSO4溶液
D. 在外电路中,电流从负极流向正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com