
欲降低废水中重金属元素铬的毒性,可将Cr2O 转化为Cr(OH)3沉淀除去。已知该条件下:
转化为Cr(OH)3沉淀除去。已知该条件下:
| 离子 | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cr3+ | 6.0 | 8.0 |
(1)某含铬废水处理的主要流程如图所示:
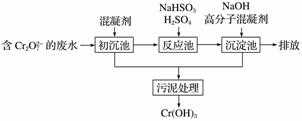
①初沉池中加入的混凝剂是K2SO4·Al2(SO4)3·2H2O,其作用为________________________(用离子方程式表示)。
②反应池中发生主要反应的离子方程式是Cr2O +3HSO
+3HSO +5H+===2Cr3++3SO
+5H+===2Cr3++3SO +4H2O。根据“沉
+4H2O。根据“沉
淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是________________________________________________________________________、
________________________________________________________________________。
证明Cr3+沉淀完全的方法是_________________________________________________。
(2)工业可用电解法来处理含Cr2O 废水。实验室利用如图装置模拟处理含Cr2O
废水。实验室利用如图装置模拟处理含Cr2O 的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+
的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+
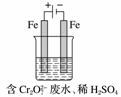
与酸性溶液中的Cr2O 反应的离子方程式是
反应的离子方程式是
________________________________________________________________________,
得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01 mol Cr2O 时,得到沉淀的质量至少是________g。
时,得到沉淀的质量至少是________g。
答案 (1)①Al3++3H2O??Al(OH)3(胶体)+3H+
②H++OH-===H2O Cr3++3OH-===Cr(OH)3↓ 测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全(其他合理答案也可)
(2)Cr2O +6Fe2++14H+===2Cr3++6Fe3++7H2O 8.48
+6Fe2++14H+===2Cr3++6Fe3++7H2O 8.48
解析 (1)Al3+水解生成Al(OH)3胶体,吸附悬浮物。因为Cr2O 被HSO
被HSO 还原成Cr3+,所以加入NaOH后,发生主要反应的离子方程式为H++OH-===H2O,Cr3++3OH-===Cr(OH)3↓。根据表中提供数据,可用测定pH的方法,若pH≥8,则证明Cr3+完全沉淀。
还原成Cr3+,所以加入NaOH后,发生主要反应的离子方程式为H++OH-===H2O,Cr3++3OH-===Cr(OH)3↓。根据表中提供数据,可用测定pH的方法,若pH≥8,则证明Cr3+完全沉淀。
(2)Cr2O +6Fe2++14H+===2Cr3+ + 6Fe3++7H2O
+6Fe2++14H+===2Cr3+ + 6Fe3++7H2O
0.01 mol 0.02 mol 0.06 mol
m(沉淀)=m[Cr(OH)3]+m[Fe(OH)3]
=0.02 mol×103 g·mol-1+0.06 mol×107 g·mol-1
=8.48 g。


科目:高中化学 来源: 题型:
有6.85 g铅的氧化物,用足量的CO在高温下将其还原,把生成的全部CO2通入到足量的澄清的石灰水中得到4.00 g 固体沉淀物,这种铅的氧化物的化学式为( )
A.PbO
B.PbO2
C.Pb3O4
D.Pb3O4和PbO2的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度( )
(2)不可能使要除去的离子全部通过沉淀除去。一般认为残留在溶液中的离子浓度小于1.0×10-5mol·L-1时,沉淀已经完全( )
(3)在一定条件下,溶解度较小的沉淀也可以转化成溶解度较大的沉淀( )
(4)常温下,向BaCO3饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小( )
(5)溶度积常数Ksp只受温度影响,温度升高Ksp增大( )
(6)常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2的Ksp不变( )
查看答案和解析>>
科目:高中化学 来源: 题型:
纯净的NaCl并不潮解,但家庭所用的食盐因含有MgCl2杂质而易于潮解。为得到纯净的氯化钠,有人设计这样一个实验:把买来的食盐放入纯NaCl的饱和溶液中一段时间,过滤即得纯净的NaCl固体。对此有下列说法,其中正确的是( )
A.食盐颗粒大一些有利于提纯
B.设计实验的根据是MgCl2比NaCl易溶于水
C.设计实验的根据是NaCl的溶解平衡
D.在整个过程中,NaCl的物质的量浓度会变大
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是( )
A.所得溶液中c(H+)=1.0×10-13 mol·L-1
B.所得溶液中由水电离产生的c(OH-)=1×10-13 mol·L-1
C.所加烧碱溶液的pH=13.0
D.所得溶液中c(Mg2+)=5.6×10-10 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃、101 kPa下:
①2Na(s)+1/2O2(g)====Na2O(s) ΔH1=-414 kJ·mol-1
②2Na(s)+O2(g)====Na2O2(s) ΔH2=-511 kJ·mol-1
下列说法正确的是:
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.0 ℃、101 kPa ,1molNa在O2中完全燃烧放出255.5KJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是:
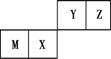
A.原子半径Z<M
B.Y的最高价氧化物对应水化物的酸性比X的弱
C.X的最简单气态氢化物的热稳定性比Z的小
D.Z位于元素周期表中第2周期第ⅥA族
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D是含同一元素的四种物质,相互之间有如图的转化关系,其中A是单质,D是最高价氧化物的水化物。那么A可能是 ( )
A.S B.Cl2 C.Fe D.Si
查看答案和解析>>
科目:高中化学 来源: 题型:
氯丁橡胶M是理想的电线电缆材料,工业上可由有机化工原料A或E制得,其合成路线如下图所示。
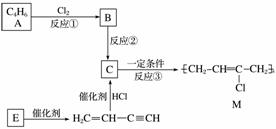
已知:H2CCHCCH由E二聚得到
完成下列填空:
(1)A的名称是________________,反应③的反应类型是________。
(2)写出反应②的化学反应方程式____________________________________________。
(3)为研究物质的芳香性,将E三聚、四聚成环状化合物,写出它们的结构简式:________________________________________________________________________。
鉴别这两个环状化合物的试剂为_______________________________________________。
(4)以下是由A制备工程塑料PB的原料之一1,4丁二醇(BDO)的合成路线:
A反应④, 反应⑤,反应⑥,BDO
反应⑤,反应⑥,BDO
写出上述由A制备BDO的化学反应方程式:
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com