
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、标准状况下,0.1NA个乙炔分子完全燃烧需要的O2的体积约为11.2L |
| B、标准状况下,11.2L乙烯分子中含有的碳碳共用电子对数目为0.5NA |
| C、15g乙烷分子中含有的碳氢键数目为3NA |
| D、常温常压下,1 mol氦气含有的核外电子数为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位.工业制硝酸的主要反应之一是:
氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位.工业制硝酸的主要反应之一是:| 浓度/mol?L-1 时间/min | c(NH3) | c(O2) | c(NO) | c(H2O) |
| 起始 | 4.0 | 5.5 | 0 | 0 |
| 第2min | 3.2 | 4.5 | 0.8 | 1.2 |
| 第4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第6min | 2.0 | 3.0 | 2.0 | 3.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
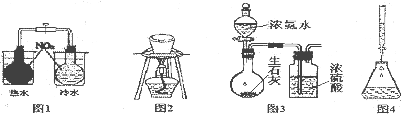
| A、用图1所示装置验证温度对反应速率的影响 |
| B、用图2所示装置从食盐水中提取氯化钠 |
| C、用图3所示装置制备干燥的氨气 |
| D、用图4所示装置量取15.00mL高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升温 |
| B、加压 |
| C、恒容下加入一定量的H2 |
| D、恒压下加入氨气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com