
| A. | 2 mol SO2和足量的O2反应,可生成2 mol SO3 | |
| B. | 达到反应限度时SO2、O2、SO3的分子数之比一定为2:1:2 | |
| C. | 达到反应限度时SO2的消耗速率必定等于O2的生成速率的2倍 | |
| D. | 若反应在恒容容器中进行,气体密度保持不变,可以判定反应到达平衡 |
分析 A、根据可逆反应中反应物不可能全部转化为生成物进行分析;
B、平衡时分子个数之比与化学计量数没有必然的联系;
C、根据达到平衡状态,正逆反应速率相等分析;
D、气体密度等于混合气体质量和体积的比值,根据化学反应来判断.
解答 解:A、可逆反应中反应物不可能全部转化为生成物,2mol二氧化硫与氧气反应,生成的SO3的物质的量一定小于2mol,故A错误;
B、平衡时SO2、O2、SO3三种物质的分子个数之比与化学计量数没有必然的联系,达到平衡状态,一定满足正逆反应速率相等,各组分浓度不变,故B错误;
C、平衡时,O2的生成速率等于O2的消耗速率,故SO2的消耗速率为O2的生成速率的2倍,故C正确;
D、若反应在恒容容器中进行,气体密度等于混合气体质量和体积的比值,质量守恒,体积恒定,所以气体密度始终保持不变,气体密度保持不变的状态不一定到达平衡,故D错误;
故选C.
点评 本题考查了可逆反应特点和化学平衡状态的判断,题目难度不大,注意可逆反应中反应物不可能全部转化为生成物,化学平衡状态的根本标志是:①v(正) =v(逆),②各组分百分含量不变;在解题时要牢牢抓住这两个根本标志,并明确气体的颜色、密度、压强、平均相对分子质量的变化与根本标志的关系,才能全面分析、正确作答.


科目:高中化学 来源: 题型:选择题

| A. | 原子序数是15 | B. | 它是非金属元素 | ||
| C. | 磷原子最外层有5个电子 | D. | 磷元素在地壳中的含量为30.97% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现用如图装置来测定原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题:
现用如图装置来测定原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ③④ | C. | ②③④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
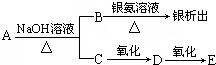
| A. | A可能易溶于水 | B. | B中既有醛基又有羧基 | ||
| C. | C的结构可能是CH3(CH3)2CH2OH | D. | E一定是链状饱和一元酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
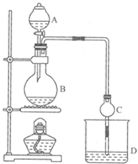 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸铵,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸铵,D中放有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
 CH3CO18OC2H5+H2O
CH3CO18OC2H5+H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com