
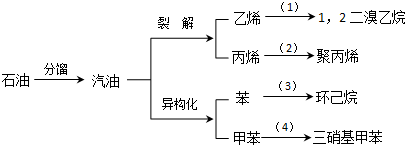
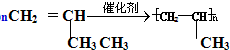 (加成聚合反应)
(加成聚合反应)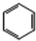 +3H2$\stackrel{催化剂}{→}$
+3H2$\stackrel{催化剂}{→}$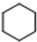 (加成反应)
(加成反应)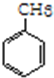 +3HO-NO2$→_{△}^{浓硫酸}$
+3HO-NO2$→_{△}^{浓硫酸}$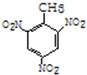 +3H2O(取代反应)
+3H2O(取代反应)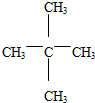 .
. .
.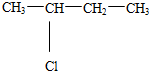 (不考虑顺反异构).
(不考虑顺反异构). 分析 (1)①烯烃与溴单质能发生加成反应得到卤代烃;
②烯烃能发生加聚反应得到聚烯烃;
③苯在催化剂的条件下能和氢气发生加成反应得到环己烷;
④甲苯能与硝酸发生取代反应;
(2)能用酸性高锰酸钾溶液鉴别说明物质遇到高锰酸钾溶液使之褪色可以鉴别;
(3)戊烷存在三种同分异构体,正戊烷、异戊烷、新戊烷,由某种烯烃和氢气加成需要分子中添加双键保证碳原子写出四个共价键,先利用减链法书写同分异构体,然后根据不能由某种烯烃和氢气加成获得判断碳原子上氢原子的种类写出结构简式;
(4)属于芳香烃,则含有1个苯环,剩余3个C,可以是丙基、甲基和乙基或者3个甲基,一溴代物只有2种,说明有2类氢原子,苯环上只有一种H;
(5)C4H10的同分异构体有:CH3CH2CH2CH3、CH3CH(CH3)CH3,利用1个Cl原子替换H原子,分析在NaOH乙醇溶液中加热发生消去反应其符合条件的结构.
解答 解:(1)①乙烯与铝化氢能发生加成反应得到氯乙烷,方程式为:CH2=CH2+Br2→CH2BrCH2Br,反应为加成反应,
故答案为:CH2=CH2+Br2→CH2BrCH2Br;加成反应;
②丙烯能发生加聚反应得到聚丙烯,方程式为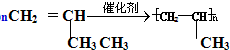 ,反应为加成聚合反应,
,反应为加成聚合反应,
故答案为: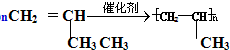 ;加成聚合反应;
;加成聚合反应;
③苯在催化剂的条件下能和氢气发生加成反应得到环己烷,反应的化学方程式为: +3H2$\stackrel{催化剂}{→}$
+3H2$\stackrel{催化剂}{→}$ 反应为加成反应,
反应为加成反应,
故答案为: +3H2$\stackrel{催化剂}{→}$
+3H2$\stackrel{催化剂}{→}$ ; 加成反应;
; 加成反应;
④甲苯能与硝酸发生取代反应, +3HO-NO2$→_{△}^{浓硫酸}$
+3HO-NO2$→_{△}^{浓硫酸}$ +3H2O,反应为取代反应,
+3H2O,反应为取代反应,
故答案为: +3HO-NO2$→_{△}^{浓硫酸}$
+3HO-NO2$→_{△}^{浓硫酸}$ +3H2O;取代反应;
+3H2O;取代反应;
(2)A.乙烯、乙炔通过高锰酸钾溶液都会被高锰酸钾溶液氧化,溶液紫红色褪去,故A错误;
B.苯、己烷在高锰酸钾溶液中都不能发生氧化反应,溶液不褪色,故B错误;
C.苯、甲苯中甲苯被高锰酸钾溶液氧化,苯不能使高锰酸钾溶液褪色,可以鉴别,故C正确;
D.己烷、环己烷 分子中都是饱和碳原子在高锰酸钾溶液中都不褪色,故D错误;
E.甲烷、乙烯中乙烯通过高锰酸钾溶液会褪色,甲烷不褪色,可以鉴别,故E正确;
故答案为:CE;
(3)戊烷的同分异构体:所有的碳原子在一条链上:CH3-CH2-CH2-CH2-CH3;拿下1个碳原子作为支链: ;拿下2个碳原子作为支链:
;拿下2个碳原子作为支链: ;其中不能由某种烯烃和氢气加成获得,说明有碳上无氢原子即只有一种氢原子,为
;其中不能由某种烯烃和氢气加成获得,说明有碳上无氢原子即只有一种氢原子,为 ,
,
故答案为: ;
;
(4)B是苯的同系物,分子式为C9H12,含有1个苯环,剩余3个C,可以是丙基、甲基和乙基或者3个甲基,一溴代物只有2种,说明有2类氢原子,苯环上只有一种H,则为间三甲苯,其结构简式为 ,
,
故答案为: ;
;
(5)C4H10的同分异构体有:CH3CH2CH2CH3、CH3CH(CH3)CH3,CH3CH2CH2CH3的一氯取代产物有两种:CH3CH2CH2CH2Cl、CH3CH(Cl)CH2CH3,CH3CH(CH3)CH3的一氯取代产物也有两种: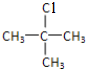 和(CH3)2CHCH2Cl,CH3CH2CH2CH2Cl、
和(CH3)2CHCH2Cl,CH3CH2CH2CH2Cl、 和(CH3)2CHCH2Cl的消去产物都只有一种,所以只有
和(CH3)2CHCH2Cl的消去产物都只有一种,所以只有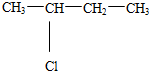 符合;
符合;
故答案为: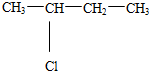 .
.
点评 本题考查有机物结构简式的确定、烯的性质、有机物的性质和方程式的书写知识、有机物的鉴别,侧重常见有机物性质的考查等,题目难度中等,注意同分异构体个数的判断、注意苯环上取代基位置的确定是解决本题的关键.


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、Na+、NH4+、Fe2+、Ba2+、Cu2+ |
| 阴离子 | OH-、I-、NO3-、AlO2-、HCO3-、HSO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乳酸 CH3-CHOH-COOH | |
| B. | 甘油 CH2OH-CHOH-CH2OH | |
| C. | 脱氧核糖 CH2OH-CHOH-CHOH-CH2-CHO | |
| D. | 核糖 CH2OH-CHOH-CHOH-CHOH-CHO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com