
 锰及其化合物在现代工业及国防建设中具有十分重要的地位.
锰及其化合物在现代工业及国防建设中具有十分重要的地位.分析 (1)根据锰原子基态原子的核外电子排布式为[Ar]3d54S2来判断锰在元素周期表中的位置;
(2)碱性锌锰电池的总反应是:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,正极MnO2得电子被还原生成MnOOH,反应式为2MnO2+2H2O+2e-═2MnOOH+2OH-;
(3)根据反应物有稀草酸,产物有二氧化碳,则说明碳元素化合价升高发生氧化还原反应,所以锰化合价降低生成二价的MnSO4,据此书写;
(4)计算ClO4-的价电子对数,结合配位原子数得到空间构型;
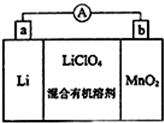
(5)形成原电池反应时,Li为负极,被氧化,电极方程式为Li-e-=Li+,MnO2为正极,被还原,电极方程式为MnO2+e-+Li+=LiMnO2;
(6)电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-=H2↑+2OH-,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为2MnO42--2e-=2MnO4-;根据关系式:2e-~H2求质量.
解答 解:(1)锰原子的原子核内有25个质子,则基态原子的核外电子排布式为[Ar]3d54S2,所以元素周期表中的位置为第四周期ⅦB族,
故答案为:第四周期ⅦB族;[Ar]3d54S2;
(2)碱性锌锰电池的总反应是:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,正极MnO2得电子被还原生成MnOOH,反应式为MnO2+H2O+e-═MnOOH+OH-,
故答案为:MnO2+e-+H2O=MnOOH+OH-;
(3)因为反应物有稀草酸,产物有二氧化碳,则说明碳元素化合价升高发生氧化还原反应,所以锰化合价降低生成二价的MnSO4,方程式为2MnOOH+H2C2O4+2H2SO4=2CO2↑+2MnSO4+4H2O,故答案为:2MnOOH+H2C2O4+2H2SO4=2CO2↑+2MnSO4+4H2O;
(4)ClO4-的价电子对数为$\frac{7+1}{2}$=4,即形成了四条新的杂化轨道,配位数为4,无孤对电子,其离子团空间构型为正四面体,故答案为:正四面体;
(5)MnO2为正极,被还原,电极方程式为MnO2+e-+Li+=LiMnO2,故答案为:Li++MnO2+e-=LiMnO2;
(6)电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-=H2↑+2OH-,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为2MnO42--2e-=2MnO4-;根据关系式:2e-~KMnO4,当电路中有2mol电子通过时,阴极上得到1molH2,m(H2)=1mol×2g/mol=2g;
故答案为:2MnO42--2e-=2MnO4-;2g.
点评 本题侧重于电化学知识以及氧化还原反应的全面考查,为高频考点,题目难度适中,能很好地考查学生的分析能力以及电化学知识的综合理解和运用,难度中等.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
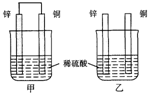
| A. | 两烧杯中铜片表面均无气泡产生 | |
| B. | 甲中铜片是正极,乙中铜片是负极 | |
| C. | 两烧杯中溶液的酸性均减弱 | |
| D. | 甲装置的导线中有电流,电流方向为锌→铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
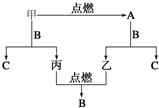 甲、乙、丙三种常见单质,A、B、C是三种常见的化合物,A为淡黄色固体,它们之间的转化关系如图所示.
甲、乙、丙三种常见单质,A、B、C是三种常见的化合物,A为淡黄色固体,它们之间的转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 电 极 | Zn C | Cu Ag | Zn Cu | Fe Zn |
| 溶 液 | 硫酸 | 硝酸银 | 蔗糖 | 硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
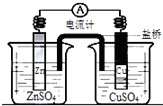
| A. | 铜是阳极,铜片上有气泡产生 | |
| B. | 锌离子在锌片表面被还原 | |
| C. | 正极附近的SO${\;}_{4}^{2-}$离子浓度逐渐增大 | |
| D. | 盐桥中的阳离子会移向CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油、煤油、植物油均为含碳氢氧三种元素的化合物 | |
| B. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,且都有同分异构体 | |
| C. | 乙酸与丙二酸互为同系物 | |
| D. | 苯能与溴发生取代反应,因此不能用苯萃取溴水中的溴 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com