
| A.只有① | B.只有④ | C.①和④都能 | D.全部都能 |
科目:高中化学 来源:不详 题型:实验题
| 实验步骤 | 有关问题 |
| (1)计算所需KCl的质量 | 需要KCl的质量为______g |
| (2)称量KCl固体 | 称量过程中主要用到的仪器有________________ |
| (3)将KCl放入到100 mL烧杯中加水溶解 | 为加快溶解速度,可采取的措施是______________________ |
| (4)将烧杯中的溶液转移至500 mL容量瓶中 | 为防止溶液溅出,应采取的措施是____________________ |
| (5)向容量瓶中加蒸馏水到刻度线 | 在进行此操作时应注意的问题是__________________________ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用稀硫酸洗掉钢铁表面的铁锈 |
| B.混有少量Fe粉的Cu粉中,加入足量稀盐酸,充分反应后过滤 |
| C.向KCl和MnO2(不溶于水)的混合物加入足量水溶解,过滤除去MnO2 |
| D.将混有少量CuCl2的FeCl2晶体,加入足量水溶解,过滤 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.为提高SO2的转化率,接触室内反应温度选定在400℃~500℃ |
| B.为防止催化剂中毒,炉气在进入接触室之前需要净化 |
| C.为防止污染大气,从吸收塔出来的尾气常用NaOH溶液吸收 |
| D.为提高SO3的吸收效率,用稀硫酸代替水吸收SO3 . |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
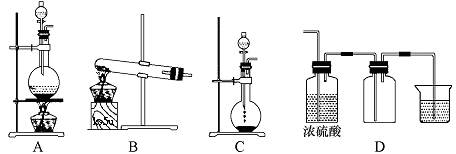

 (1)实验室可以用B和C装置制取氨气,如果用C装置,通常使用的药品是 。检查C装置气密性是否良好的操作方法是
(1)实验室可以用B和C装置制取氨气,如果用C装置,通常使用的药品是 。检查C装置气密性是否良好的操作方法是 查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
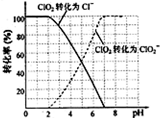
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
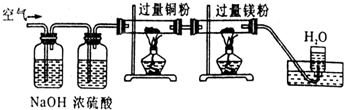
| A.CO2、H2O、O2、N2 | B.H2O、CO2、N2、O2 |
| C.CO2、N2、H2O、O2 | D.N2、O2、CO2、H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 硫酸 |
| 物质 数据 | 乙醇 | 溴乙烷 | 1,2-二溴乙烷 | 乙醚 | 浓硫酸 |
| 密度/g?cm-3 | 0.79 | 1.46 | 2.2 | 0.71 | 1.84 |
| 熔点(℃) | -130 | -119 | 9 | -116 | 10 |
| 沸点(℃) | 78.5 | 38.4 | 132 | 34.6 | 338 |
| 在水中的溶解度(g/100g水) | 互溶 | 0.914 | 1 | 7.5 | 互溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com