
【题目】溶液中同时存在![]() 和
和![]() 四种金属离子(浓度均为0.1mol/L)。现用碱调节溶液pH,根据下表可知,下列说法错误的是( )
四种金属离子(浓度均为0.1mol/L)。现用碱调节溶液pH,根据下表可知,下列说法错误的是( )
物质 | 溶度积( |
|
|
|
|
|
|
|
|
A.Al3+最先转化为Al(OH)3沉淀
B.加碱过程中,![]() 几乎同时转化为沉淀
几乎同时转化为沉淀
C.要使Mg2+转化为沉淀,溶液pH应大于9
D.![]() 时,四种金属离子全部以沉淀形式存在
时,四种金属离子全部以沉淀形式存在
【答案】D
【解析】
A、根据溶度积的大小计算四种金属离子开始沉淀时所需OH-的浓度,OH-的浓度最小的先沉淀;
B、根据溶度积的大小计算可知,Fe2+、Mn2+开始沉淀时所需OH-的浓度值相差极小,加入NaOH时二者几乎同生成沉淀;
C、根据溶度积先计算氢氧根浓度,再根据水的离子积常数计算氢离子浓度,再求pH;
D、pH=14时溶液呈强碱性,铝元素不可能以Al3+存在,而是以AlO2-存在。
根据物质的溶度积常数可知,以Mg2+为例,Ksp=c(Mg2+)×c2(OH-),c(Mg2+)浓度为0.1mol/L,设c(OH-)浓度为x,带入Ksp表达式得:0.1×x2=1.2×10-11,解得:x≈1.1×10-5mol/L,则Mg2+开始沉淀时的OH-的浓度值为1.1×10-5,同理可得Fe2+、Mn2+和Al3+三种金属离子开始沉淀时的OH-的浓度分别是4×10-7mol/L、6.3×10-7mol/L、2.4×10-11mol/L;
A、由以上分析可知,Al3+开始沉淀时所需OH-的浓度值最小,Al3+最先转化为Al(OH)3沉淀,故A正确;
B、由以上分析可知,Fe2+、Mn2+开始沉淀时所需OH-的浓度值相差极小,故加碱过程中,Fe2+、Mn2+几乎同时转化为沉淀,故B正确;
C、由以上分析可知,Mg2+开始沉淀时所需OH-的浓度值为1.1×10-5,c(H+)=![]() ,pH=9.04,故C正确;
,pH=9.04,故C正确;
D、氢氧化铝为两性氢氧化物,在pH=14时,氢氧化铝会溶解生成偏铝酸钠,故D错误;
故选D。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片插入同浓度的稀硫酸中一段时间,下列叙述正确的是![]()
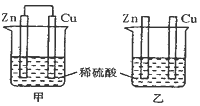
A.甲中铜片是正极,乙中铜片是负极
B.甲中铜被氧化,乙中锌被氧化
C.甲中锌片上的反应为:![]()
D.两烧杯中铜片表面均无气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验误差分析错误的是( )
A. 用湿润的pH试纸测稀碱液的pH,测定值偏小
B. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D. 测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当氢氧化镁固体在水中达到溶解平衡Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,须加入少量的( )
Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,须加入少量的( )
A.MgCl2B.NaOHC.MgSO4D.H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.用标准NaOH溶液滴定充满HCl的烧瓶(标况下,烧瓶容积为V L)做完喷泉实验后得到的稀盐酸(水充满整个烧瓶)以测定它的准确浓度,用酚酞作指示剂。请你回答下列问题:
(1)计算该盐酸的物质的量浓度为:_____。(保留三位有效数字)
(2)现有三种浓度的标准NaOH溶液,你认为最合适的是下列第_____种。
①5.00molL﹣1②0.500molL﹣1③0.0500molL﹣1
(3)若采用上述最合适浓度的标准NaOH溶液滴定,滴定时实验数据列表如下:
实验次数编号 | 待测盐酸体积(mL) | 滴入NaOH溶液体积(mL) |
1 | 10.00 | 8.48 |
2 | 10.00 | 8.52 |
3 | 10.00 | 8.00 |
求这种待测稀盐酸的物质的量浓度c(HCl)=_____。与理论计算值比较,造成的误差的原因可能是哪些下列操作导致的_____
①滴定前平视,滴定终了俯视
②滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定终了无气泡
③滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗
④看到颜色变化后立即读数 ⑤洗涤锥形瓶时,误把稀食盐水当做蒸馏水进行洗涤
II.测定绿矾FeSO4·xH2O中结晶水含量
Ⅰ.准确称量27.8 g绿矾样品,配成250 mL溶液;
Ⅱ.量取25.00 mL所配制的溶液于锥形瓶中;
Ⅲ.用硫酸酸化的0.100 0 mol·L1 KMnO4溶液滴定至终点;
Ⅳ.重复操作3次,消耗KMnO4溶液的体积分别为20.02 mL、24.98 mL、19.98 mL。
(1)判断达到滴定终点时的实验现象是_____。
(2)根据实验记录,计算绿矾化学式中结晶水数目x=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于甲、乙、丙、丁、戊五种溶液有如下信息:
①分别NH4+、Na+、Al3+、Ba2+、Ag+和NO3-、Cl-、SO42-、Br-、CO32-离子中的各一种组成(不重复)。
②其中甲、丙、戊三种溶液呈酸性,乙溶液呈碱性。
③甲、乙反应生成白色沉淀和气体,丁可分别与甲、乙、丙反应生成白色沉淀。
请回答下列问题:
⑴用化学式表示出各物质:乙___________、丁_____________。
⑵请用离子方程式表示戊溶液呈酸性的原因:________________________________。
⑶请用离子方程式表示甲与乙的反应:______________________________________。
⑷检验甲溶液中甲的阴离子的方法是先加_______________试剂,再加_________试剂,观察到
________________现象,证明该阴离子存在。
⑸若丙、丁形成的白色沉淀的溶度积常数Ksp=1.8×10-20,则将1 L 1mol/L的丙溶液与1 L 1 mol/L的丁溶液混合充分反应后,不考虑溶液混合时的微小体积变化,形成沉淀的阳离子的浓度约为_______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A | B | C | D |
通电一段时间后,搅拌均匀,溶液的pH增大 | 此装置可实现 铜的精炼 | 盐桥中的K+ 移向FeCl3溶液 | 若观察到甲烧杯中石墨电极附近先变红,则乙烧杯中铜电极为阳极 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义pC=-lgC,pKa=-lgKa,常温下,某浓度H2A溶液在不同pH值下,测得pC(H2A)、pC(HA﹣)、pC(A2﹣)变化如图所示,下列说法正确的是
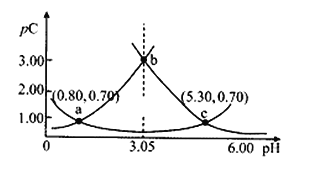
A.随着pH的增大,pC增大的曲线是A2﹣的物质的量浓度的负对数
B.pH=3.50时,c(HA﹣)> c(H2A) > c(A2﹣)
C.b点时c(H2A)·c(A2﹣)/c2(HA﹣)=10﹣4.5
D.pH=3.00~5.30时,c(H2A)+c(HA﹣)+c(A2﹣)先减小后增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随加水体积变化的曲线如图所示。下列说法正确的是

A. HB的酸性强于HA
B. a点溶液的导电性大于b点溶液
C. 同浓度的NaA与NaB溶液中,c(A-)=c(B-)
D. 加水稀释到pH相同时,酸HA、HB用到的水V(A)小于V(B)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com