
| A. | 大于10s | B. | 等于10s | C. | 小于10s | D. | 无法判断 |
分析 计算反应物的浓度由3mol/L降到2mol/L时的平均反应速率,再假设以相同的反应速率计算反应物的浓度由2mol/L降到1mol/L所需反应时间,实际上反应所需时间比这个时间少,据此分析解答.
解答 解:若反应物的浓度由3mol/L降到2mol/L需10s,如反应速率不变,则反应物浓度由2mol/L降到1mol/L所需的时间也是10s,但随着反应的进行,浓度逐渐减小,则反应速率逐渐减小,则反应物浓度由2mol/L降到1mol/L的速率小于浓度由3mol/L降到2mol/L的速率,时间大于10s.
故选A.
点评 本题考查化学反应速率的有关计算,难度不大,明确化学反应速率是平均值不是瞬时值,化学反应速率随浓度的变化而变化.


科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成amolX,同时生成3amolY | |
| B. | X、Y、Z的分子数之比为1:3:2 | |
| C. | Z的生成速率与Z的分解速率相等 | |
| D. | 单位时间生成3amolY,同时生成3amolZ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该物质属于芳香族化合物 | B. | 它的分子式是C16H10N2O2 | ||
| C. | 靛蓝完全燃烧生成二氧化碳和水 | D. | 它是不饱和的有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性氧化物一定是金属氧化物 | |
| B. | 金属氧化物一定是碱性氧化物 | |
| C. | 酸性氧化物、碱性氧化物一定都能与水反应生成相应的酸、碱 | |
| D. | 酸性氧化物一定是非金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀 | |
| B. | 原电池反应是导致金属腐蚀的主要原因,故不能用原电池原理来减缓金属的腐蚀 | |
| C. | 钢铁电化学腐蚀的两种类型主要区别在于水膜的酸性不同,引起的正极反应不同 | |
| D. | 无论哪种类型的腐蚀,其实质都是金属被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
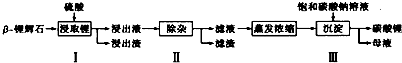
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com