
常见的非金属元素及化合物的特征性质有着重要的应用,请按要求回答:
(1)C、N、O、Si、S、Cl等元素形成的单质中
①属于空气主要成分它们相互反应的化学方程式_____________________;
②常用于自来水消毒的是实验室制备该气体的化学方程式_____________________。
(2)在CO、CO2、SO2、NO、NO2、SiO2等氧化物中:
①其中属于酸性氧化物的是______________,能形成酸雨的是_____________。
②光导纤维的主要成分与烧碱反应的化学方程式为___________________。
(3)在浓(稀)硝酸、浓(稀)硫酸中:
①常温下能使Fe、Al钝化的是_________。
②见光易分解的反应的化学方程式是:_____________________。
(4)在H2O2、NH3、HCl中:
①被称作绿色氧化剂,它与FeSO4酸性溶液反应的离子方程式为_______________________。
②可用于制氮肥、纯碱,加热条件下与氧气反应的化学方程式为_________________。
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸、碱、盐及氧化物都是电解质 | |
| B. | 电解质溶液能导电是因为发生了电离,产生了自由移动的离子 | |
| C. | 电解质不一定能导电,能导电的物质不一定是电解质 |
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上适应性考试二化学试卷(解析版) 题型:填空题
根据要求回答下列问题:
(1).制取MgCl2的过程中涉及反应:MgCl2.6H2O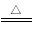 MgCl2+6H2O,该反应要在HCl气氛中进行,原因是____________________。
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是____________________。
(2).在实验室模拟氯碱工业电解饱和食盐水,用玻璃棒蘸浓氨水检验阳极产生的气体,生成大量白烟。写出化学方程式____________________。直接电解氯化钠稀溶液可制备“84”消毒液,所得消毒液仅含一种溶质,写出相应的化学方程式:___________________,下列措施能增强“84”消毒液杀菌能力的是___________(填序号)
A.加入适量醋酸b.加入适量亚硫酸
c.加入少量NaOH粉末D.加入适量的稀盐酸
(3).生活中常用ClO2净化自来水,将SO2通入硫酸酸化的KClO3可以制备ClO2,氧化剂和还原剂的物质的量之比为__________。有效氯含量可以来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为__________(结果保留小数点后1位)。
(4).某学习小组探究过氧化钠和二氧化硫的化学反应,有同学认为类似于过氧化钠和二氧化碳的反应,有同学认为二氧化硫全被氧化,现向过氧化钠中通入足量的二氧化硫,请设计实验证明二氧化硫部分被氧化:___________________。
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上适应性考试二化学试卷(解析版) 题型:选择题
下列有关物质性质的应用的说法正确的是
A.金属活泼性铜比铁弱.可在铁船闸上装铜块减缓其腐蚀
B.MgO的熔点很高,可用于制作耐高温材科
C.铝能置换出氧化铁中的铁,可用于钢铁工业中大量冶炼铁
D.二氧化硫有漂白、杀菌性能,可在食品生产中大量使用
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:选择题
在1L含0.2molKOH、0.1molNaAlO2和0.1 mol Ba(NO3) 2 的混合溶液中,逐滴加入浓度为0.1 mol/L 的H 2 SO 4 溶液,下列图像中能表示反应产生的沉淀的物质的量和所加入硫酸溶液的体积关系是(已知AlO2-和Ba2+可以大量共存)

查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:选择题
碳酸钙是一种用途非常广泛的产品,可用于生成硫酸、漂白粉等一系列物质(见图)。下列说法正确的是
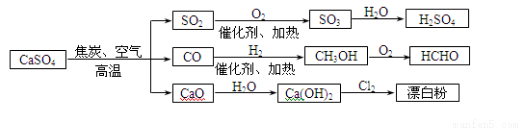
A.CO、SO2均为无色有刺激性气味的有毒气体
B.工业上利用Cl2 和澄清石灰水反应来制取漂白粉
C.除去与水反应,图示转化反应均为氧化还原反应
D.用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100%
查看答案和解析>>
科目:高中化学 来源:2017届山西大学附中高三上10月模块诊断化学试卷(解析版) 题型:填空题
中国自古有“ 信口雌黄”、“雄黄入药”之说。雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。根据题意完成下列填空:
信口雌黄”、“雄黄入药”之说。雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。根据题意完成下列填空:
(1) 砷元素有+2、+3两种常见价态。As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体,写出该反应的化学方程式_____________________。
(2) 上述反应中的氧化剂是___________;氧化产物是___________;反应产生的H2S气体可用____________吸收。
(3)As2S3和HNO3有如下反应:As2S3+10H++ 10NO3—=2H3AsO4+3S+10NO2↑+ 2H2O。若生成1mol H3AsO4,则反应中转移电子的物质的量为___________;若将该反应设计成一原电池,则NO2应该在___________(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2LO2(标准状况)混合后用水吸收全部转化 成浓HNO3,然后与过量的碳反应,写出碳与浓硝酸反应的化学方程式__________________;所产生的CO2的量___________(选填编号)。
成浓HNO3,然后与过量的碳反应,写出碳与浓硝酸反应的化学方程式__________________;所产生的CO2的量___________(选填编号)。
A.小于0.5mol B.等于0.5mol C.大于0.5mol D.无法确定
查看答案和解析>>
科目:高中化学 来源:2016-2017学年海南省琼海市高一上学期第一次月考化学试卷 题型:选择题
设NA为阿伏伽德罗常数的值,下列有关说法不正确的是
A.常温下,48gO3含有的氧原子数3NA
B.标准状况下,33.6LCO中含有的原子数是3NA
C.0.5mol·L-1CaCl3溶液中含Cl-数目为NA
D.17gNH3所含的电子数为10NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com