
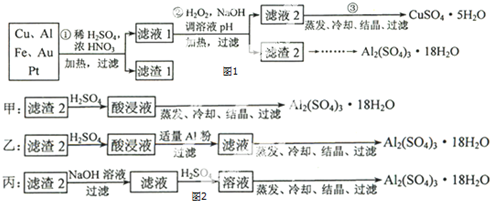
分析 本题是以含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物制备硫酸铜和硫酸铝晶体的流程,涉及了用离子方程式表示反应原理,利用绿色氧化剂过氧化氢氧化二价铁离子得到三价铁,然后通过调整溶液的pH使Fe3+、Al3+沉淀,然后先用碱溶液溶解沉淀,过滤后再用酸溶解沉淀,得到的溶液再分别结晶,另外还涉及利用滴定原理测定胆矾晶体的质量分数,据此可作答;
(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+;所以滤渣1 的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+;
(2)过氧化氢具有氧化性且被还原为水,无杂质无污染;可以氧化亚铁离子为铁离子易于沉淀除去,调节溶液PH目的是铁离子和铝离子全部沉淀;第②步加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境无污染.调溶液PH的目的是使Fe3+和Al3+形成沉淀.所以滤液2的成分是Cu2+,滤渣2的成分为氢氧化铁和氢氧化铝;
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水;
(4)依据实验方案过程分析制备晶体中是否含有杂质,使用的试剂作用,原料的利用率,原子利用率因素分析判断;
(5)依据滴定实验和反应离子方程式计算得到;滴定实验误差分析依据标准溶液消耗的多少进行分析判断.
解答 解:(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+;所以滤渣1的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+;第①步Cu与酸反应的离子方程式为:Cu+4H++2NO3-$\frac{\underline{\;加热\;}}{\;}$Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-$\frac{\underline{\;加热\;}}{\;}$3Cu2++2NO↑+4H2O,Au、Pt不能被硝酸溶解,就为滤渣;
故答案为:Cu+4H++2NO3-$\frac{\underline{\;加热\;}}{\;}$Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-$\frac{\underline{\;加热\;}}{\;}$3Cu2++2NO↑+4H2O;Au、Pt;
(2)第②步加H2O2的作用是将Fe2+氧化为Fe3+;过氧化氢做氧化剂不引入杂质,对环境无污染;调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜,故答案为:将Fe2+氧化为Fe3+;不引入杂质,对环境无污染;Fe3+、Al3+;
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水,故答案为:加热脱水;
(4)制备硫酸铝晶体的甲、乙、丙三种方法中,甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行;乙和丙方法均可行;乙方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;丙方案先在滤渣中加NaOH和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体,但从原子利用率角度看,方案乙原子利用率高,
故答案为:甲;所得产品中含有较多Fe2(SO4)3杂质;乙;
(5)取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用c mol•L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL.滴定反应如下:Cu2++H2Y2-=CuY2-+2H+
铜离子物质的量和标准液物质的量相同=cmol/L×b×10-3L=bc×10-3mol;依据元素守恒得到:
则20ml溶液中含有的CuSO4•5H2O物质的量为bc×10-3mol;100ml溶液中含bc×10-3mol×5=5bc×10-3mol;
所以CuSO4•5H2O质量分数的表达式=$\frac{cmol•L{\;}^{-1}×b×10{\;}^{-3}L×250g•mo{l}^{-1}×5}{ag}$×100%;
a.未干燥锥形瓶对实验结果无影响;
b.滴定终点时滴定管尖嘴中产生气泡说明消耗标准液读数偏小,结果偏低;
c.未除净可与EDTA反应的干扰离子,消耗标准液多,结果偏高;
故答案为:$\frac{cmol•L{\;}^{-1}×b×10{\;}^{-3}L×250g•mo{l}^{-1}×5}{ag}$×100%;c.
点评 本题考查离子分离的方法,实验设计,试剂选择,中和滴定的简单计算和误差的分析,离子性质的熟练掌握是解题关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
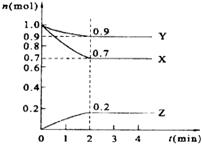 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示. 查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室用NaBr、浓H2SO4、乙醇为原料,制备溴乙烷,反应的化学方程式为:
实验室用NaBr、浓H2SO4、乙醇为原料,制备溴乙烷,反应的化学方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5 mol•L-1•s-1 | B. | v(B)=0.5 mol•L-1•s-1 | ||
| C. | v(C)=1.8 mol•L-1•min-1 | D. | v(D)=1 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和② | B. | ①和③ | C. | ②和③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com