
| A. | H + NO3- Fe 2+ Na + | B. | Ag + NO3- Cl - K + | ||
| C. | K + Ba 2+ OH - SO42- | D. | Cu 2+ NH4+ Br - OH - |
分析 具有还原性的离子与氧化性的离子发生氧化还原反应,不能大量共存,以此来解答.
解答 解:A.Fe 2+具有还原性,H+和NO3-具有氧化性,三者发生氧化还原反应,不能大量共存,故A选;
B.Ag+和Cl-不能共存,因复分解反应不能大量共存,不发生氧化还原反应,故B不选;
C.Ba2+与SO42-反应生成BaSO4不能大量共存,因复分解反应不能大量共存,不发生氧化还原反应,故C不选;
D.Cu 2+与OH -、NH4+与OH-均不能共存,因复分解反应不能大量共存,不能发生氧化还原反应,故D不选;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,注意硝酸根离子在酸性条件下表现出强氧化性,可以氧化还原某些物质,这一点往往容易疏忽,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 核素就是同位素 | |
| B. | 元素的金属性强弱与元素失去电子数的多少成正比 | |
| C. | 具有相同质子数的微粒一定是同一种元素 | |
| D. | 核内中子数为N的R2+,质量数为A,则该离子的核外电子数为A-N-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
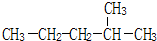 2-甲基戊烷
2-甲基戊烷 2,3-二甲基-1-丁烯
2,3-二甲基-1-丁烯 1,2-二溴乙烷
1,2-二溴乙烷 乙苯
乙苯查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋和淀粉-KI试纸检验碘盐中的KIO3:IO3-+5I-+6H+═3I2+3H2O | |
| B. | 稀HNO3溶液与难溶于水的FeS固体:FeS+2H+═Fe2++H2S↑ | |
| C. | 碳酸氢钙与少量的NaOH溶液反应 Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | Na与水的反应Na+H2O═Na++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向含Fe2+、Br-、I-各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中某种离子的物质的量的关系如图,下列说法中正确的是( )
向含Fe2+、Br-、I-各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中某种离子的物质的量的关系如图,下列说法中正确的是( )| A. | Q是I- | |
| B. | Q是Br- | |
| C. | ab区间的反应:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | b点时溶液中只有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加盐酸酸化的BaCl2溶液,生成白色沉淀,原溶液中一定含有SO42- | |
| B. | 将钾盐溶于盐酸,产生能使澄清石灰水变浑浊的气体,该钾盐一定为K2C03 | |
| C. | 某固体进行焰色反应实验,火焰呈黄色,说明该固体为钠盐 | |
| D. | 向某溶液中滴加KSCN溶液,不变色,再滴加氯水显红色,则 溶液中一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 ②
② ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A. | 有机物①分子中所有原子不可能在同一平面上 | |
| B. | 有机物②与硝基乙烷(CH3CH2NO2)互为同分异构体 | |
| C. | 有机物①与②的核磁共振氢谱具有相同数目的吸收峰 | |
| D. | 有机物①能与浓溴水发生加成反应和取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com