
| X | Y | |
| Z |
| A. | Y的单质与水反应时,Y的单质既是氧化剂又是还原剂 | |
| B. | X的最高价氧化物对应的水化物与其气态氢化物可以反应生成盐 | |
| C. | X、Y、Z元素形成的单质,常温下Z单质的沸点最底 | |
| D. | X的氢化物只有一种 |
分析 X、Y、Z都是短周期元素,由元素在周期表中的位置可知,X、Y处于第二周期,Z处于第三周期,令x的原子序数为a,则Y原子序数为a+2、Z原子序数为a+9,由X、Y原子序数之和等于Z的原子序数,则a+a+2=a+9,解得a=7,则X为N、Y为F、Z为S,以此解答该题.
解答 解:由以上分析可知X为N、Y为F、Z为S元素,
A.氟气与水反应生成HF和氧气,氟气只起到氧化剂的作用,故A错误;
B.X为N,对应的最高价氧化物对应的水化物与其气态氢化物反应生成硝酸铵,为铵盐,故B正确;
C.Z的单质常温下为固体,而其它两种为气体,S的单质沸点最高,故C错误;
D.X为N,对应的氢化物有NH3、N2H4等,故D错误.
故选B.
点评 本题考查元素周期表与元素周期律,为高考常见题型,侧重考查学生的分析能力,难度不大,根据同主族元素原子序数关系进行推断是关键,注意元素周期律的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 碘单质的升华过程中不存在化学键破坏的过程 | |
| B. | NaCl溶于水后,因为共价键被破坏,从而形成了Na+和Cl- | |
| C. | 在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成 | |
| D. | H2S分子中,所有原子的最外层都达到了8电子的稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
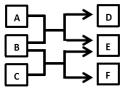 X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol•L-1D溶液的pH为13(25℃).它们满足如图转化关系,则下列说法正确的是( )
X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol•L-1D溶液的pH为13(25℃).它们满足如图转化关系,则下列说法正确的是( )| A. | 由X、Y、Z、W四种元素组成的盐溶液pH小于7 | |
| B. | 化合物F中含有共价键和离子键 | |
| C. | 0.1molB与足量C完全反应共转移电子数为0.2NA | |
| D. | Z元素的最高正价为+6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol蔗糖完全水解生成葡萄糖分子数为2 NA | |
| B. | 在氢氧碱性燃料电池中,若正极消耗22.4L气体(标准状况),则转移电子数为2NA | |
| C. | 16.0 gCuO和Cu2S的混合物含阴离子数为0.2NA | |
| D. | 2.24L(标准状况)一氯甲烷分子中含共价键数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
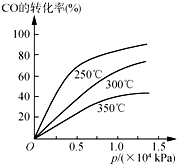 工业上一般在密闭容器中采用下列反应合成甲醇:
工业上一般在密闭容器中采用下列反应合成甲醇:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | NaHA的电离方程式为NaHA?Na++HA- | B. | B点:c(H2A)+c(H+)=c(OH-)+c(A2-) | ||
| C. | C点:c(Na+)=c(A2-)+c(HA-) | D. | D点:c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com