
| 0.2mol |
| 2 |
| 0.2mol |
| 2 |
| 40 |
| 64 |
| 7 |
| 56 |
| 1.28g |
| 32g/mol |


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
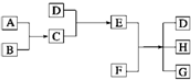 已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如图所示:
已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V (盐酸)/mL(初始) | 0.00 | 0.20 | 0.10 | 0.10 |
| V (盐酸)/mL(终点) | 20.98 | 21.22 | 21.10 | 21.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、②中所含官能团种类比③中多 |
| B、①、④互为同系物 |
| C、①、②、③、④均能与氢氧化钠溶液反应 |
| D、等物质的量②、③分别在足量氧气中完全燃烧,前者消耗氧气比后者少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
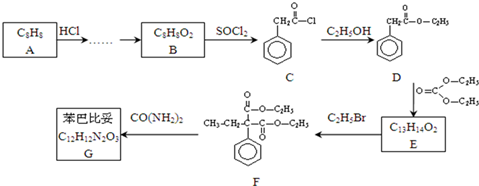



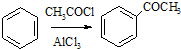 ,请设计合理方案以B的同系物
,请设计合理方案以B的同系物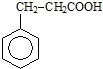 为原料合成
为原料合成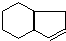 (用合成路线流程图表示为:A
(用合成路线流程图表示为:A| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com