
【题目】下列说法不正确的是( )
A.同温、同压下,相同质量的气体都占有相同的体积
B.同温、同压下,相同体积的气体都含有相同数目的分子
C.同温、同压下,CH4与O2的密度之比1:2
D.由0.2gH2和8.8gCO2、5.6gCO组成混合气体,在标准状况下的体积约为11.2L
【答案】A
【解析】
A.根据PV=nRT,同温、同压下,相同质量的气体,由于摩尔质量可能不同,所以物质的量不一定相等,则占有的体积不一定相同,A选项错误;
B.根据PV=nRT,同温、同压下,相同体积的气体物质的量相同,则气体所含的分子数目相同,B选项正确;
C.结合理想气体状态方程和ρ=![]() ,可得
,可得![]() ,即同温同压下气体的密度之比等于相对分子质量之比,因此,同温、同压下,CH4与O2的密度之比为16:32=1:2,C选项正确;
,即同温同压下气体的密度之比等于相对分子质量之比,因此,同温、同压下,CH4与O2的密度之比为16:32=1:2,C选项正确;
D.根据公式![]() 计算可得0.2gH2物质的量为0.1mol、8.8gCO2物质的量为0.2mol、5.6gCO物质的量为0.2mol,则混合气体总物质的量为0.5mol,所以标准状况下体积约为11.2L,D选项正确;
计算可得0.2gH2物质的量为0.1mol、8.8gCO2物质的量为0.2mol、5.6gCO物质的量为0.2mol,则混合气体总物质的量为0.5mol,所以标准状况下体积约为11.2L,D选项正确;
答案选A。


科目:高中化学 来源: 题型:
【题目】硼、碳、镓、砷、硒的化合物被广泛应用于新材料制备、生活生产等诸多领域。根据物质结构相关知识,回答下列问题:
(1)第四周期镓、砷、硒三种元素中,第一电离能由大到小顺序为___,电负性由大到小顺序为___(用元素符号填写)
(2)元素氮与砷同族。基态氮元素的价电子排布式为___,预测砷的氢化物分子的立体结构为___,其沸点比NH3的___(填“高”或“低”),其判断理由是___。
(3)硼及化合物应用广泛。已知BP的熔点很高,其晶胞结构如图所示。
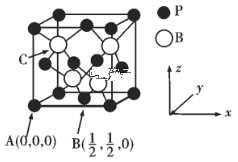
C点的原子坐标为___,B原子与P原子的最近距离为dpm,晶体的密度为pg/cm3,NA代表阿伏加德罗常数的值,则ρ=___g/cm3(用含d、NA的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同一条件下,体积相同的三个烧瓶中分别盛有NH3、HCl、NO2气体,并分别倒立在水槽中,充分反应后(已知:3NO2+H2O =2HNO3+NO,NO不溶于水),烧瓶内三种溶液的物质的量浓度之比为(设烧瓶中的溶液未扩散到水槽里)
A. 3:3:2 B. 2:2:3 C. 1:1:1 D. 2:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容的密闭容器中充入适量NO2,发生如下反应:2NO2(g) ![]() N2O4(g),当分离出部分N2O4时,下列说法中正确的是( )
N2O4(g),当分离出部分N2O4时,下列说法中正确的是( )
A. υ(正)增大B. 平衡逆向移动C. υ(正)>υ(逆)D. NO2转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙、丁、戊五种烃,已知它们是C2H6、C2H4、C2H2、C6H6、C6H12(环烷烃)中的一种,实验现象如下:
①甲、乙能使溴水因发生化学反应而褪色;②0.5mol甲能与1molH2反应生成丙,丙不能使溴水和酸性高锰酸钾溶液褪色;③戊可由丁在一定条件下与氢气反应得到。
(1)甲的电子式是___;丙的结构式是____。
(2)写出下列反应的化学方程式:
A.乙与溴水反应______。
B.丁生成戊的反应_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84 g/cm3 )配制100 mL l mol/L的稀硫酸。现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,按使用仪器的先后顺序排列正确的是.( )
A.④③⑦⑤⑥;B.②⑤⑦⑥;C.①③⑤⑥⑦;D.②⑥③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,向500~600 ℃的铁屑中通入氯气生产无水氯化铁。现用如图所示的装置模拟上述过程进行实验。
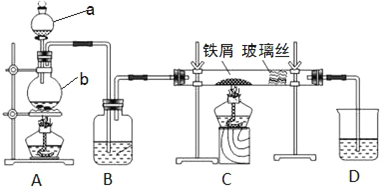
(1)写出仪器的名称:a_______,b________。
(2)A中反应的化学方程式为________。C中反应的化学方程式为________。
(3)装置B中加入的试剂是________。
(4)已知:向热铁屑中通入氯化氢气体可以生产无水氯化亚铁。为防止有杂质FeCl2生成,可在装置__和__(填字母)间增加一个盛有________的洗气瓶。
(5)装置D的作用是________。为防止水蒸气影响无水氯化铁的制取,请你提出一个对装置D的改进方案:________。
(6)反应结束后,取少量装置C中的固体于试管中,加入足量盐酸,固体完全溶解,得到溶液X。证明溶液X中含有FeCl3的试剂是________,观察到的现象是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有X、Y、Z三种常见短周期元素,X 的原子结构示意图为![]() ,Y、Z为同周期金属元素,Y、Z的最高价氧化物对应水化物可以反应生成盐和水。回答下列问题:
,Y、Z为同周期金属元素,Y、Z的最高价氧化物对应水化物可以反应生成盐和水。回答下列问题:
(1)已知Y2X2为浅黄色固体物质,其阴阳离子个数比为_______,其中含有的化学键类型有_________。
(2)将单质 Z 的薄片在酒精灯上加热至熔化,观察到的现象是___________,产生该现象的原因是___________。
(3)Y、Z最高价氧化物对应的水化物混合反应生成盐和水的离子方程式为____________________。
(4)若(3)中生成物还可表示为YZ(OH)4,则YZ(OH)4与过量HC1溶液反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.向Na2SiO3中通入过量CO2:Na2SiO3 +2CO2+2H2O![]() H2SiO3↓+2HCO3-+2Na+
H2SiO3↓+2HCO3-+2Na+
B.KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
C.用热的NaOH溶液溶解S:3S+4OH- ![]() 2S2-+SO2↑+2H2O
2S2-+SO2↑+2H2O
D.酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+ ![]() 2Mn2++5O2↑+8H2O
2Mn2++5O2↑+8H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com