
 �о��������������ڴ����еĺ������ӵ������ʱ���漰���·�Ӧ��
�о��������������ڴ����еĺ������ӵ������ʱ���漰���·�Ӧ������ ��1����֪����2NO2��g��+NaCl��s��?NaNO3��s��+ClNO��g����
��2NO��g��+Cl2��g��?2ClNO��g����
���ݸ�˹���ɢ١�2-�ڿɵã�4NO2��g��+2NaCl��s��?2NaNO3��s��+2NO��g��+Cl2��g������÷�Ӧƽ�ⳣ��Ϊ�ٵ�ƽ�ⳣ��ƽ����ڵ��̣�
��2������Ӧ���ھ����ܱ������н��У�2NO2��g��+NaCl��s��?NaNO3��s��+ClNO��g����K1 ��H1��0����ӦΪ���ȷ�Ӧ����Ӧ�����¶����ߣ�
��3�����淴Ӧ�ﵽƽ��״̬��һ���������淴Ӧ������ȣ�����ֵ�Ũ�ȡ��ٷֺ������ٱ仯���ݴ˽����жϣ�
��4���� NO �� Cl2 ��ʼ���ʵ���֮��Ϊ x��ƽ��ʱ Cl2 ��ת����Ϊ a����ϻ�ѧ���м�����ʽ������ƽ�������� ClNO ���������Ϊy������õ���
��5��0.2mol NaOH��ˮ��Һ��0.2mol NO2ǡ����ȫ��Ӧ��1L��ҺA����ӦΪ2NO2+2NaOH�TNaNO3+NaNO2+H2O���õ���Һ��NaNO3���ʵ���Ũ��Ϊ0��mol/L��NaNO2���ʵ���Ϊ0.1mol/L����ҺBΪ0.1mol•L-1��CH3COONa��Һ����֪HNO2�ĵ��볣��Ka=7.1��10-4mol•L-1��CH3COOH�ĵ��볣��Ka=1.7��10-5mol•L-1��˵��CH3COOH����С��HNO2�����ԣ���Ӧ������ˮ��̶ȴݴ˷����жϣ�
��� �⣺��1��2NO2��g��+NaCl��s��?NaNO3��s��+ClNO��g�� K1 ��H��0 ��I��
2NO��g��+Cl2��g��?2ClNO��g�� K2 ��H��0 ��II��
���ݸ�˹���ɣ����2-��ɵã�4NO2��g��+2NaCl��s��?2NaNO3��s��+2NO��g��+Cl2��g������÷�Ӧƽ�ⳣ��K=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$���ʴ�Ϊ��$\frac{{{K}_{1}}^{2}}{{K}_{2}}$��
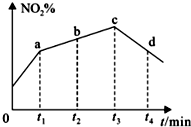
��2������Ӧ���ھ����ܱ������н��У�2NO2��g��+NaCl��s��?NaNO3��s��+ClNO��g����K1 ��H1��0����ӦΪ���ȷ�Ӧ��ʵ����NO2�� g ����ת������ʱ��仯��ʾ��ͼ��t3��t 4 ʱ�̣�NO2��g����ת���� ��NO2%�����ͣ���ӦΪ���ȷ�Ӧ�ҷ�Ӧ����Ϊ�������������ŷ�Ӧ�Ľ��У���ϵ���¶Ȼ����ߣ����ٴδ�ƽ��ʱ��ת���ʻή�ͣ�
�ʴ�Ϊ����ӦΪ���ȷ�Ӧ�ҷ�Ӧ����Ϊ�������������ŷ�Ӧ�Ľ��У���ϵ���¶Ȼ����ߣ����ٴδ�ƽ��ʱ��ת���ʻή�ͣ�
��3��2NO��g��+Cl2��g��?2ClNO��g����K2��H2��0����ӦΪ���������С�ķ��ȷ�Ӧ��
A����Ӧǰ���������ʵ����仯��������ѹǿ���ٱ仯��˵����Ӧ�ﵽƽ��״̬����A��ȷ��
B��n �� ClNO ��=n �� NO ������˵�����淴Ӧ������ͬ������֤����Ӧ�ﵽƽ��״̬����B����
C��������������䣬�����������ܶ�ʼ�ղ��䣬����˵����Ӧ�ﵽƽ��״̬����C����
D����Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ��� �� �� NO ��=�� �� �� ClNO ������ �� �� NO ��=�� �� �� ClNO ��˵��ClNO�����淴Ӧ������ͬ����D��ȷ��
�ʴ�Ϊ��AD��
��4���� NO �� Cl2 ��ʼ���ʵ���֮��Ϊ x��ƽ��ʱ Cl2 ��ת����Ϊ a����ϻ�ѧ���м�����ʽ��
2NO��g��+Cl2��g��?2ClNO��g��
��ʼ����mol�� x 1 0
�仯����mol�� 2a a 2a
ƽ������mol�� x-2a 1-a 2a
����ƽ�������� ClNO ���������Ϊy=$\frac{2a}{x+1-a}$��
�ʴ�Ϊ��y=$\frac{2a}{x+1-a}$��
��5��0.2mol NaOH��ˮ��Һ��0.2mol NO2ǡ����ȫ��Ӧ��1L��ҺA����ӦΪ2NO2+2NaOH�TNaNO3+NaNO2+H2O���õ���ҺA��NaNO3���ʵ���Ũ��Ϊ0��mol/L��NaNO2���ʵ���Ϊ0.1mol/L����ҺBΪ0.1mol•L-1��CH3COONa��Һ����֪HNO2�ĵ��볣��Ka=7.1��10-4mol•L-1��CH3COOH�ĵ��볣��Ka=1.7��10-5mol•L-1��˵��CH3COOH����С��HNO2�����ԣ���Ӧ������ˮ��̶ȴ�������Ӻ������������ˮ�⣬����Һ��c��NO3-����c��NO2-����c��CH3COO-���ɴ�С��˳��Ϊ��c��NO3-����c��NO2-����c��CH3COO-����
��ҺBΪ0.1mol•L-1��CH3COONa��Һ�������£�����Һ B �м�ˮϡ�����У�
a��ϡ����������������Ũ�ȼ�С����Һ�д������ӻ���������������Ũ������$\frac{c��{H}^{+}��}{c��O{H}^{-}��}$��ֵ����a��ȷ��
b����ˮϡ�ʹٽ�����$\frac{c��O{H}^{-}��}{c��C{H}_{3}COOH��}$��ֵ����b��ȷ��
c����Һ�м�ˮϡ�ͣ�$\frac{c��N{a}^{+}��}{c��C{H}_{3}CO{O}^{-}��}$=$\frac{n��N{a}^{+}��}{n��C{H}_{3}CO{O}^{-}��}$��������������ʵ�����С����ֵ����c��ȷ��
d��$\frac{c��C{H}_{3}CO{O}^{-}��c��{H}^{+}��}{c��C{H}_{3}COOH��}$Ϊ����ƽ�ⳣ������ʽ���¶Ȳ������ƽ�ⳣ�����䣬��d����
�ʴ�Ϊ��c��NO3-����c��NO2-����c��CH3COO-���� a��b��c��
���� ���⿼���˻�ѧƽ�ⳣ���ļ��㣬Ӱ�컯ѧƽ������ط���Ӧ�ã��������Һ������ˮ�⣬����Ũ�ȴ�С�Ƚϣ�������ҺPH�ķ��������жϣ����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�


 Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д�
Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д� �������Ͽ�ʱͬ��ѵ��ϵ�д�
�������Ͽ�ʱͬ��ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ȼ�þ | B�� | �������� | C�� | ���� | D�� | �ƾ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ϳɰ���ҵ������ѹǿ����߷�Ӧ���ת���� | |
| B�� | ��������ֽ�Ӷ���������������ʹ��λʱ���ڲ��������������� | |
| C�� | ��ӦCO��g��+NO2��g���TCO2��g��+NO��g��������ӦΪ���ȷ�Ӧ������ƽ��������¶���ϵ��ɫ���� | |
| D�� | ����ɫ����ˮ���պ���ɫ��dz |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ��/mol•L-1 | 0.64 | 0.50 | 0.50 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1�� | B�� | 2�� | C�� | 3�� | D�� | 5�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.5mol/L | B�� | 0.01mol/L | C�� | 0.02mol/L | D�� | 0.05mol/L |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com