
 化学反应过程中总是伴随着能量的变化,能量间可以相互转化.
化学反应过程中总是伴随着能量的变化,能量间可以相互转化.分析 (1)根据CH4和CO的燃烧热写出热化学方程式,再据盖斯定律解答;
(2)热化学方程式中,反应焓变=反应物的总键能-生成物的总键能,据此计算;
(3)每生成1.12kg纯硅需吸收akJ热量,结合物质的量与反应放出的热量成正比计算;
(4)根据化学反应热的计算公式Q=cm△T来计算;
(5)依据盖斯定律和已知热化学方程式求出Cl2(g)+PCl3(g)=PCl5(g)的反应热,再依据焓变=反应物键能之和-生成物键能之和计算分析.
解答 解:(1)CH4和CO的燃烧热分别为809kJ/mol和283kJ/mol,其热化学方程式为:
①CH4(g)+2O2(g)=CO2(g)+2 H2O(l)△H=-809kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ•mol-1
据盖斯定律,①-②×4得:CH4(g)+3CO2(g)?4CO(g)+2H2O(g)△H=+323kJ/mol,
故答案为:+323;
(2)N2(g)+O2(g)?2NO(g),已知N2、O2、NO三种分子中化学键断裂所吸收的能量依次为946kJ•mol-1、498kJ•mol-1、632kJ•mol-1,反应焓变△H=(946kJ•mol-1+498kJ•mol-1)-2×632kJ•mol-1=+180kJ/mol,
故答案为:+180;
(3)每生成1.12kg纯硅需吸收akJ热量,则生成1mol纯硅吸收的热量为$\frac{28a}{1.12×1{0}^{3}}$kJ=0.025akJ,所以该反应的热化学方程式为2H2(g)+SiCl4(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1,
故答案为:2H2(g)+SiCl4(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1;
(4)将100mL 0.50mol/L的CH3COOH溶液与100mL 0.55mol/L NaOH溶液混合,完全反应生成0.05mol水放出的热量为:Q=cm△T=[150.5J/K+4.184J/(g•K)×200mL×1g•mL-1]×(300.7-298.0)K=2665.71kJ,则生成1mol水放出的热量为:2665.71kJ×$\frac{1mol}{0.05mol}$=53314.2J≈5.33×104J=53.3 kJ,
所以CH3COOH的中和热△H=-53.3 kJ/mol,
故答案为:-53.3kJ/mol;
(5)已知:①P4(g)+6Cl2(g)=4PCl3(g)△H=a kJ?mol-1;
②P4(g)+10Cl2(g)=4PCl5(g)△H=b kJ?mol-1;
利用“盖斯定律”,(②-①)×$\frac{1}{4}$得:Cl2(g)+PCl3(g)=PCl5(g)△H=$\frac{b-a}{4}$kJ•mol-1,
由Cl2(g)+PCl3(g)=PCl5(g)△H=$\frac{b-a}{4}$kJ•mol-1 可得E(Cl-Cl)+3×1.2c-5c=$\frac{b-a}{4}$,
因此可得:E(Cl-Cl)=$\frac{b-a+5.6c}{4}$kJ•mol-1=1.4c+0.25b-0.25akJ•mol-1,
故答案为:1.4c+0.25b-0.25a.
点评 本题考查了反应热的计算、中和热的测定,题目难度中等,注意掌握盖斯定律的含义及利用盖斯定律计算反应热的方法,明确测定中和热的原理、操作方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 如果XCl2I2分子呈正方形结构,则没有同分异构体 | |
| B. | 如果XCl2I2分子呈正方形结构,则不可能为极性分子 | |
| C. | 如果XCl2I2分子呈四面体结构,则为极性分子 | |
| D. | 如果XCl2I2分子呈四面体结构,则有2种手性异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)同一物质存在气态的熵值最大,液态的熵值次之,固态的熵值最小.若同温同压下,一个反应生成物气体的体积等于反应物气体的体积就可粗略认为该反应的熵变为0.某化学兴趣小组,专门研究了氧族元素及其某些化学物的部分性质.所查资料如下:
(1)同一物质存在气态的熵值最大,液态的熵值次之,固态的熵值最小.若同温同压下,一个反应生成物气体的体积等于反应物气体的体积就可粗略认为该反应的熵变为0.某化学兴趣小组,专门研究了氧族元素及其某些化学物的部分性质.所查资料如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
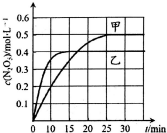 臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)?N2O5(g)+O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如下表及图所示,下列说法正确的是( )
臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)?N2O5(g)+O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如下表及图所示,下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积/L | 1 | 1 | 2 |
| 反应物起始量 | 2mol NO2,1mol O3 | 2mol NO2,1mol O3 | 2mol NO2,1mol O3 |
| 温度 | T1 | T2 | T2 |
| A. | 0~10min内甲容器中反应的平均速率:v(NO2)=0.02mol•L-1•min-1 | |
| B. | T1<T2,△H>0 | |
| C. | 平衡时N2O5浓度:c乙(N2O5)>c丙(N2O5) | |
| D. | T1℃时,若起始时间向容器甲中充入2molNO2、1molO3、2molN2O5和2mol O2,则脱硝反应达到平衡前,v(正)<c(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
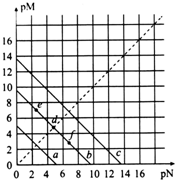 已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp(CaCO3)=2.8×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子).下列说法正确的是( )
已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp(CaCO3)=2.8×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子).下列说法正确的是( )| A. | a线代表的是PbCO3 | |
| B. | T℃时,向10 mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+):c(Pb2+)=3×10-5 | |
| C. | T℃时,向CaSO4沉淀中加入1 mol/L的Na2CO3溶液,CaSO4沉淀会转化为CaCO3沉淀 | |
| D. | T℃时,向CaCO3悬浊液中加入NH4Cl固体,会使图象中d点向f点转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H<0 | |
| B. | 为处理银器表面的黑斑(Ag2S),将银器浸于铝质容器里的食盐水中并与铝接触 | |
| C. | 常温下,将稀CH3COONa溶液加水稀释后,溶液中n(H+)•n(OH-)不变 | |
| D. | 在盛有Ca(OH)2悬浊液的绝热密闭容器中,加入少量的CaO粉末后,溶液中Ca2+数目不变,pH降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、蒸馏、分液 | B. | 分液、蒸馏、萃取 | C. | 蒸馏、蒸馏、萃取 | D. | 蒸馏、分液、萃取 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com