
| A. | 苯(甲苯):加酸性高锰酸钾溶液、再加NaOH溶液,分液 | |
| B. | 乙烷(乙烯),催化条件下通入H2 | |
| C. | 乙酸(乙醛),加入新制氢氧化铜,蒸馏 | |
| D. | 乙醛(乙酸),加入氢氧化钠溶液洗涤,蒸馏 |
分析 A.甲苯被高锰酸钾氧化生成苯甲酸,与NaOH反应后与苯分层;
B.乙烯与氢气反应,易引入新杂质氢气;
C.乙醛与新制氢氧化铜反应,乙酸与氢氧化铜反应;
D.乙酸与NaOH反应后,增大与乙醛的沸点差异.
解答 解:A.甲苯被高锰酸钾氧化生成苯甲酸,与NaOH反应后与苯分层,然后分液可分离,故A正确;
B.乙烯与氢气反应,易引入新杂质氢气,应选溴水、洗气,故B错误;
C.乙醛与新制氢氧化铜反应,乙酸与氢氧化铜反应,将原物质除去,不能除杂,故C错误;
D.乙酸与NaOH反应后,增大与乙醛的沸点差异,然后蒸馏可分离,故D正确;
故选AD.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析与应用能力的考查,注意有机物性质的综合应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 实验组序 | 温度/℃ | 起始量/mol | 平衡量/mol | ||||
| CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||||
| 1 | 500 | 2 | 4 | 0 | 1 | ||
| 2 | 500 | 1.4 | 2.8 | 0.6 | a | ||
| 3 | 750 | 0 | 0 | 2 | 0.8 | ||
| 4 | 750 | 0.8 | 1.6 | 1.2 | b | ||
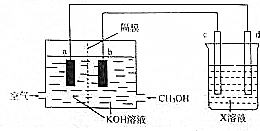
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
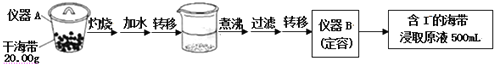
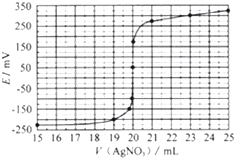
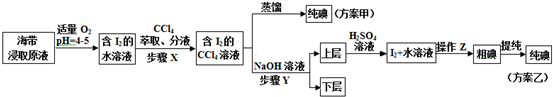
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-、HCO3-、Na+ | B. | Cu2+、NH4+、OH- | C. | Ba2+、K+、NO3- | D. | Ag+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不确定 | B. | 变小 | C. | 不变 | D. | 变大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com