



 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
| A、(a) | B、(b) |
| C、(a)(c) | D、(a)(d) |
查看答案和解析>>
科目:高中化学 来源: 题型:
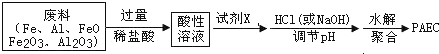
| ① |
| 过量稀硫酸 |
| ②操作a |
| ③双氧水 |
| H+ |
| ④氨水 |
| 操作b |
| ⑤灼烧 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 测定时刻/s | t1 | t2 | t3 | t4 |
| C(A)/mol?L-1 | 6 | 3 | 2 | 2 |
| C(B)/mol?L-1 | 5 | 3.5 | 3 | 3 |
| C(C)/mol?L-1 | 1 | 2.5 | 3 | 3 |
| A、在容器中发生的反应为2A(g)+B(g)?2C(g) |
| B、该温度下,此反应的平衡常数为0.25 |
| C、A的转化率比B转化率的低 |
| D、在t3时刻反应已经停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.
氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.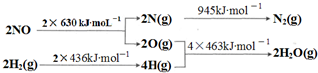
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑥ | B、①③④⑥ |
| C、③④⑤⑥ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用托盘天平称取NaCl固体29.25g |
| B、应选用500 mL的容量瓶来配制此溶液 |
| C、在转移操作中不慎将溶液洒到容量瓶外面,应该重新配置溶液 |
| D、加蒸馏水至离刻度线1-2 cm时改用胶头滴管定容 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞 |
| B、施肥时,草木灰(有效成分为K2CO3)不能与碳铵混合使用 |
| C、厨房中常用碳酸钠溶液洗涤餐具上的油污 |
| D、配制FeCl2溶液时常常要在溶液中加入少量铁粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com