
| A. | 同一周期,从左到右,第一电离能逐渐增大 | |
| B. | 第一电离能越大,金属性越强 | |
| C. | 第三周期,从左到右,主族元素电负性逐渐增大 | |
| D. | 电负性越大,原子半径越大 |
分析 A.同周期第ⅡA、第ⅤA元素电离能比相邻元素都要大;
B.电离能越大,越难失去电子;
C.同周期从左到右元素的非金属性增强;
D.根据电负性、原子半径的递变规律判断.
解答 解:A.同周期第ⅡA、第ⅤA元素电离能比相邻元素都要大,总体呈增大的趋势,但不是一定增大,故A错误;
B.第三周期中Na的金属性最强,但第一电离能最小,故B错误;
C.同周期从左到右元素的非金属性增强,所以同周期自左而右电负性逐渐增大,故C正确;
D.同主族元素从上到下,元素的非金属性逐渐减弱,但原子半径逐渐增大,故D错误.
故选C.
点评 本题考查元素周期律知识,为高考高频考点,侧重于学生的分析能力的考查,注意把握元素的性质与对应单质、化合物的性质的关系以及比较角度,难度不大.


科目:高中化学 来源: 题型:填空题

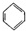 +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$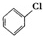 +HCl
+HCl| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是铵盐均能与苛性钠共热产生氨气 | |
| B. | 向铜粉中加人稀硫酸,铜粉不溶解;再加人Cu(NO3)2固体,铜粉溶解 | |
| C. | 普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高 | |
| D. | 将二氧化硫通人溴水,溴水褪色后加热不能恢复原色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | |
| D | E | F |
| A. | D的单质是常见的半导体材料 | |
| B. | B与E形成的化合物不只一种 | |
| C. | C与F的原子序数之差为8 | |
| D. | A的最高价氧化物的水化物能和Al(OH)3反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. ;D、E形成的化合物:
;D、E形成的化合物: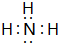 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
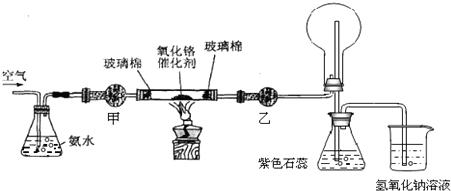
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氧化亚铁和稀硫酸的反应 FeO+2H+═Fe3++H2O | |
| B. | 用食醋清洗水垢(主要成分是碳酸钙)2CH3COOH+CO32-═2CH3COO-+CO2↑+H2O | |
| C. | 稀硝酸可溶解新制的氢氧化铜悬浊液Cu(OH)2+2H+═Cu2++2H2O | |
| D. | 盐酸和氨水反应 H++NH3•H2O═H2O+NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com