
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解
(1)卤族元素位于周期表的_________区
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在。使氢氟酸分子缔合的作用力是_______
(3)请根据下表提供的第一电离能数据判断:理论上最有可能生成较稳定的单核阳离子的卤素原子是___________(填名称或元素符号)
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
(4)已知高碘酸有两种形式,化学式分别为H5IO6(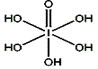 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4 (填“>”、 “<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4 (填“>”、 “<”或“=”)
(5)已知ClO2-为V型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出与ClO3-互为等电子体的分子的分子式__________(写出1个)
(6)如图为碘晶体晶胞结构。有关说法中正确的是_____________
 A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以配位数4交替配位形成层结构
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以配位数4交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘分子间存在非极性键和范德华力
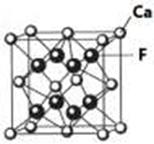
(7)已知CaF2晶体(见图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻且最近的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________
科目:高中化学 来源: 题型:
[化学——选修3:物质结构与性质](15分)
已知:A、B、C、D为周期表1~36号中的元素,它们的原子序数逐渐增大。A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;D的基态原子的M电子层上有4个未成对电子。
请回答下列问题:
(1)D是元素周期表中第________周期,第________族的元素;其基态原子的外围电子排布式为________。
(2)A、B、C、D四种元素中,电负性最大的是________(填元素符号)。
(3)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为________。B的氢化物的沸点远高于A的氢化物的沸点的主要原因是_____________________________________________________________
_____________________________________________________________。
(4)D能与AC分子形成D(AC)5,其原因是AC分子中含有________________。D(AC)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断D(AC)5晶体属于________(填晶体类型)。
(5)SiO2的晶胞可作如下推导:先将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成Si原子,再在每两个不共面的“小立方体”中心处各放置一个Si原子便构成了晶体Si的一个晶胞。再在每两个相邻的Si原子(距离最近的两个Si原子)中心连线的中点处增添一个O原子,便构成了SiO2晶胞,故SiO2晶胞中有________个Si原子,________个O原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列几种情况都有白色沉淀物质生成,其中生成物化学成分相同的是 ( )
①块状纯碱久置于空气中生成的白色粉末
②盛澄清石灰水的烧杯内壁附着的白色物质
③生石灰久置于空气中生成的白色物质
④Na2SiO3水溶液置于敞口容器中,溶液中出现的白色浑浊物
A.①④ B.②③ C.①② D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
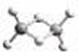
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n。已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高。Al2H6球棍模型如下图。下列有关说法不正确的是
A.Al2H6在固态时所形成的晶体是分子晶体
B.氢铝化合物可能成为未来的储氢材料和火箭燃料
C.Al2H6中含有离子键和极性共价键
D.Al2H6在空气中完全燃烧,产物为氧化铝和水
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是(NA为阿伏加德罗常数)
A.1molP4含有p—p键的个数为4NA
B.1molSiC中含有C—Si键的个数为2NA
C.含C为1mol的金刚石中含有C—C键的个数为2NA
D.1molSi02中含Si—O键的个数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H2(g)+Cl2(g)=2HCl(g) △H=—184.6kJ·mol-1, 则反应HCl(g)= H2(g)+
H2(g)+ Cl2(g)的△H为
Cl2(g)的△H为
A.+184.6kJ·mol-1 B.—92.3kJ·mol-1
C.—369.2kJ·mol-1 D. +92.3kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,把一定量NH3充入容积固定的密闭容器中,发生反应2NH3 (g) 3H2(g)+N2(g)。达到平衡时,如果保持温度不变,增加N2的浓度。下列说法正确的是
3H2(g)+N2(g)。达到平衡时,如果保持温度不变,增加N2的浓度。下列说法正确的是
A.平衡向正反应方向移动 B.化学平衡常数不变
C.化学平衡常数增大 D.化学平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
氨气是中学化学中常见的气体,其用途广泛。
(1)实验室制取氨气的化学方程式是 。
 (2)工业上氨气可以由氢气和氮气合成。
(2)工业上氨气可以由氢气和氮气合成。








① 该反应的热化学方程式是 。
② 随着温度的升高,该反应的化学平衡常数的变化趋势是 。
③ 一定温度下,2 L密闭容器中,5 molN2和5 molH2发生反应,达到平衡时,N2的转化率为20%,该温度下反应的平衡常数的数值是 。
④ 简述一种检查氨气是否泄露可采用的化学方法: 。
(3)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。
① 写出氨水吸收SO2 的化学反应方程式 。
② (NH4)2SO3显碱性,用化学用语和必要的文字解释其原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
以铜为电极,a mol/L的硫酸铜溶液作电解液,对含有铁、锌、银的粗铜进行电解精炼,下列有关说法中正确的是( )
①粗铜应与电源的负极相连
②当有1 mol精铜析出时,就有2NA个电子通过电解质溶液
③阴极上的反应只有:Cu2++2e-===Cu
④电解结束时,c(CuSO4)<a mol/L
⑤杂质银以Ag2SO4形式沉入电解池形成“阳极泥”
A.②③ B.③④
C.①②④⑤ D.①③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com