
依题意可知:
![]()
含CuO(4.24 - 0.02×12)÷80=0.05 mol
若CuO全部被还原为Cu,其质量应为0.05×64=3.20g。
故反应后的混合物应由Cu和Cu2O组成,
其中Cu2O:(3.36-3.20)÷16=0.01 mol
Cu2O质量的分数为:
0.01×144÷3.36×100%=42.9%
Cu的质量分数为:1- 42.9%=57.1%</PGN0093B.TXT/PGN>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ①先后加入沉淀剂A、B |
| ②过滤 |
| ③先后通入NH3CO2 |
| ④过滤 |
| ⑤煅烧 |

| 84n-53m |
| 31m |
| 84n-53m |
| 31m |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)依题意判断,原溶液__________(填“是”或“不是”)饱和溶液;
(2)t℃下,该盐的溶解度为__________;
(3)若向原溶液中添加4.0 g溶质,则需要加入多少克水,才能使溶液恰好达到饱和。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省临沂市高三5月高考模拟理综化学试卷(解析版) 题型:实验题
工业生产纯碱的过程如下:
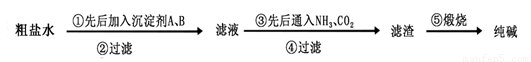
完成下列填空:
(1)粗盐水(含杂质离子Mg2+、Ca2+),加入沉淀剂A、B除杂质(A来源于石灰窑厂),则沉淀剂B 的化学式为 。
(2)实验室模拟由滤液制备滤渣的装置如下:
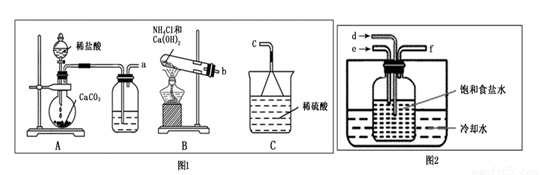
①图1中装置和图2中装置的连接方法为a接 ,b接 ,f接c。
②图2中试剂瓶内发生的化学反应方程式为 。
③实验中要求通入的NH3过量之后再通入CO2气体,检验通入的NH3已过量的实验操作是 。
(3)操作⑤煅烧后的纯碱中含有未分解的碳酸氢钠。某同学称取该纯碱样品m g,再充分加热至质量不再变化时称得剩余固体的质量为n g,则纯碱样品中碳酸钠的质量分数为 。
(4)现有25℃下,0.1mol/LNH3·H2O溶液和0.1mol/LNH4Cl溶液,将两份溶液等体积混合测得溶液的pH=9,下列说法正确的是 (填代号)。
a.0.1mol/L NH4Cl溶液与混合后溶液中导电粒子的种类和数目均相同
b.混合后的溶液中,c(NH3·H2O)>c(Cl-)>c(NH4+)>c(OH-)>c(H+)
c.由题意可知,NH3·H2O的电离程度大于同浓度的NH4Cl的水解程度
d.混合前两份溶液的pH之和大于14
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com