
【题目】实验室用100 mL 0.500 mol·L-1的NaOH溶液捕获CO2,一定时间后,测定CO2的吸收量。方法是用盐酸逐滴加入到吸收CO2后的溶液中,产生的CO2气体的物质的量与加入盐酸的体积示意图如下:
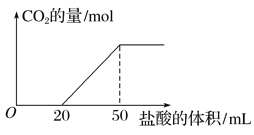
求:(1)吸收的CO2在标准状况下的体积是________ mL。
(2)盐酸的物质的量浓度是________mol·L-1。
【答案】 672 1.00
【解析】(1)碳酸钠和稀盐酸反应方程式为:Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑,根据图像,加入稀盐酸时没有气体生成,如果溶质完全是碳酸钠,碳酸钠和稀盐酸反应生成碳酸氢钠、碳酸氢钠和稀盐酸反应生成二氧化碳时消耗的稀盐酸体积应该相等,实际上两段消耗盐酸量是20mL和30mL,不等,说明溶液中溶质有Na2CO3和NaHCO3。当盐酸的体积为50mL时,溶液中的溶质为NaCl,根据钠离子和氯离子守恒,n(NaOH)= n(HCl),因此n(HCl)=0.1L×0.5mol/L=0.05mol,c(HCl)=![]() =1.00mol/L。生成二氧化碳最多时消耗30mL盐酸,根据NaHCO3+HCl=NaCl+H2O+CO2↑,可知CO2体积(标准状况下)为0.03L×1mol/L×22.4L/mol=0.672L=672mL,故答案为:672;
=1.00mol/L。生成二氧化碳最多时消耗30mL盐酸,根据NaHCO3+HCl=NaCl+H2O+CO2↑,可知CO2体积(标准状况下)为0.03L×1mol/L×22.4L/mol=0.672L=672mL,故答案为:672;
(2)当盐酸的体积为50mL时,溶液中的溶质为NaCl,根据钠离子和氯离子守恒,n(NaOH)= n(HCl),因此n(HCl)=0.1L×0.5mol/L=0.05mol,c(HCl)=![]() =1.00mol/L,故答案为:1.00。
=1.00mol/L,故答案为:1.00。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X和W同主族且W的单质是重要的半导体材料,Y原子的最外层电子数是其内层电子数的3倍,Z2+与Y2-核外电子排布相同。下列说法正确的是
A. X的氢化物中仅含有极性键
B. X与Y形成的三原子分子的电子式是![]()
C. 原子半径Z>Y,离子半径Z2+< Y2-
D. X、Y的非金属性强弱可用其氧化物的水化物的酸性强弱来推断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从元素化合价升降的角度分析,下列不属于氧化还原反应的是
A. H2+Cl2![]() 2HCl B. 2HClO
2HCl B. 2HClO![]() 2HCl+O2
2HCl+O2
C. 2NaI+Br2=2NaBr+I2 D. CaCl2+Na2CO3=CaCO3↓+2NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
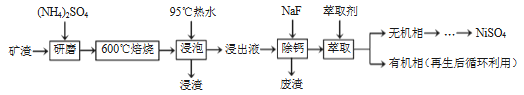
【题目】镍及其化合物用途广泛。某矿渣的土要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,如图是从该矿渣中回收NiSO4的工艺路线:
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4,NiFe2O4在焙烧过程中
生成NiSO4、Fe2(SO4)3。锡(Sn)位子第五周期第IVA族.
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是________________。
(2)"浸泡“过程中Fe2(SO4)3生成FeO(OH)的离子方程式为__________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有____________ (填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将 Fe3+还原为Fe2+ ,所需SnCl2的物质的量不少于Fe3+物质的量的_____倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+ ,还原产物为Cr3+,滴定时反应的离子方程式________________。
⑷“浸出液”中c(Ca2+) =1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-)=______mol·L-1。[己知Ksp(CaF2) > 4.0×10-11]
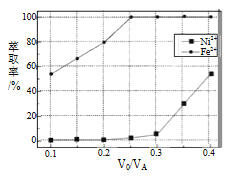
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值是__________。
(6)己知正十二烷可用作该工艺的萃取剂。用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷。己知电解总反应为:
2C6H13COONa + 2CH3OH![]() C12H26 + 2CO2↑+H2↑+2CH3ONa
C12H26 + 2CO2↑+H2↑+2CH3ONa
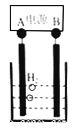
下列说法正确的是(_____)
A.图中电源的A极为直流电源的负极
B.加入金属钠可以将酸转化为钠盐,提高离子浓度,增强导电性
C.阳极电极反应为:2C6H13COO--2e- =C12H26+2CO2↑
D.反应一段时间后将电源正负极反接,会产生杂质影响正十二烷的制备
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为合成2-氧代环戊羧酸乙酯K和聚酯L的路线:
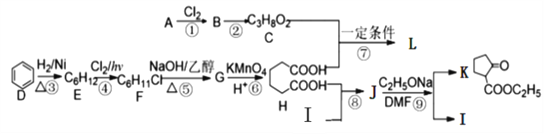
已知如下信息:
Ⅰ.链烃A可生产多种重要有机化工原料,在标准状况下的密度为1.875 g·L-1。
Ⅱ. 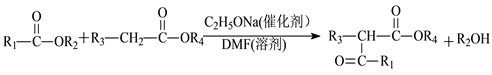
请回答以下问题:
(1)A的键线式为____________,K中含氧官能团名称为:_________________。
(2)②的反应条件是_______________,⑥的反应类型是__________________。
(3)写出反应⑤的化学方程式:_________________________________________;
(4)与H官能团的种类和数目完全相同的同分异构体有_____种(不包括H),其中核磁共振氢谱为4组峰,且峰面积之比为1:2:3:4的是______________(写结构简式)。
(5)利用以上合成路线中的相关信息,请写出以乙醇为原料制备![]() ,(其他试剂任选)的合成路线流程图____________________________________________
,(其他试剂任选)的合成路线流程图____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础,下列实验设计原理正确的是
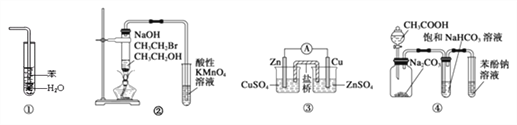
A. 装置①:可用于吸收NH3,并防止倒吸
B. 装置②:验证溴乙烷发生消去反应生成烯烃
C. 装置③:观察原电池装置中电流表指针偏转
D. 装置④:由实验现象推知酸性强弱顺序为CH3COOH>H2CO3>C6H5OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
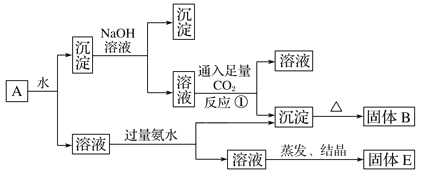
据此判断:
(1)固体B所含物质的化学式为___________________________________________。
(2)固体E所含物质的化学式为__________________________________。
(3)反应①的离子方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学实验的叙述中,正确的是( )
A. 蒸馏操作时应将温度计的水银球插入液面下
B. 制乙酸乙酯时,将乙醇沿器壁注入浓硫酸中
C. NaOH溶液可以保存在带橡胶塞的试剂瓶中
D. 用溶解、过滤的方法除去粗盐中的氯化钙和氯化镁等杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究盐酸被氧化的条件,进行如下实验。
(1)研究盐酸被MnO2氧化。
实验 | 操作 | 现象 |
Ⅰ | 常温下将MnO2和12mol/L浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
Ⅱ | 将Ⅰ中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
Ⅲ | 加热MnO2和4mol/L稀盐酸混合物 | 无明显现象 |
①Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是_________。
②Ⅱ中发生了分解反应,反应的化学方程式是_________。
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计试验Ⅳ进行探究(如图1):
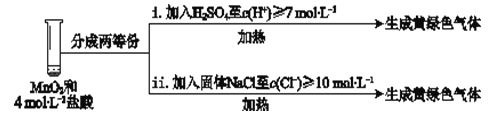
将实验Ⅲ、Ⅳ作对比,得出的结论是_______;将实验现象Ⅳ中的i、ii作对比,得出的结论是_______。
④用如图装置(a、b均为石墨电极)进行实验Ⅴ:
ⅰ、K闭合时,指针向左偏转
ⅱ、向右管中滴加浓H2SO4至c(H+)>7mol/L,指针偏转幅度变化不大
ⅲ、再向左管中滴加浓H2SO4至c(H+)>7mol/L,指针向左偏转幅度增大
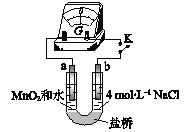
将实验V中的ⅰ和ⅱ、ⅲ作对比,得出的结论是___________。
(2)研究盐酸能否被氧化性酸氧化。
①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象。由此得出浓硫酸___________(填“能”或“不能”)氧化盐酸。
②向试管中加入3mL浓盐酸,在加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2。
通过实验Ⅰ、Ⅱ、Ⅲ证明混合气体中含有Cl2,Ⅲ的操作是_________。
实验 | 操作 | 现象 |
Ⅰ | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
Ⅱ | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
Ⅲ | …… | 试纸先变蓝,不褪色 |
(3)由上述实验得出:盐酸能否被氧化与氧化剂的种类、__________有关。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com