
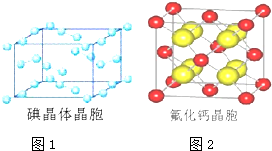
分析 (1)碘为分子晶体,晶胞中占据顶点和面心,以此分析;
(2)利用均摊法确定该立方体中含有的离子,根据ρV=nM计算相对分子质量.
解答 解:(1)A.碘分子的排列有2种不同的取向,在顶点和面心不同,2种取向不同的碘分子以4配位数交替配位形成层结构,故A正确;
B.用均摊法可知平均每个晶胞中有4个碘分子,即有8个碘原子,故B错误
C.碘晶体为无限延伸的空间结构,构成微粒为分子,是分子晶体,故C错误;
D.碘晶体中的碘原子间存在I-I非极性键,且晶体中分子之间存在范德华力,故D正确;
故答案为:AD;
(2)该晶胞中含有钙离子个数=$\frac{1}{8}×8+6×\frac{1}{2}$=4,氟离子个数为8,则晶胞体积V=a3,CaF2密度为=$\frac{m}{V}$=$\frac{M×4}{V{N}_{A}}$=ρ,则CaF2的相对分子质量M=$\frac{{a}^{3}ρ{N}_{A}}{4}$,
故答案为:$\frac{{a}^{3}ρ{N}_{A}}{4}$.
点评 本题考查物质结构与性质、晶体结构与性质及晶胞的计算,侧重对主干知识的考查,需要学生熟练掌握基础知识,题目难度中等.


科目:高中化学 来源: 题型:解答题
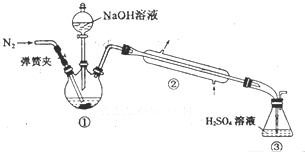 某小组以废铁屑、稀硫酸、饱和(NH4)2SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X.为确定其组成,进行如下实验.
某小组以废铁屑、稀硫酸、饱和(NH4)2SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X.为确定其组成,进行如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NC13中N-C1键键长比CCl4中C-C1键键长短 | |
| B. | NC13分子中的所有原子均达到8电子稳定结构 | |
| C. | NCl3分子是极性分子 | |
| D. | NBr3的沸点比NCl3的沸点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、X、Y形成的简单离子,其半径大小关系为W>X>Y | |
| B. | M、W元素形成的简单氢化物的稳定性:W>M | |
| C. | X是同周期中金属性最强的元素 | |
| D. | Z的最高价氧化物对应的水化物的浓溶液能与Y的单质在常温下剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度\时间 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
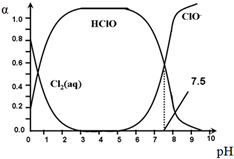 氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强.25℃时氯气-氯水体系中存在以下平衡关系:
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强.25℃时氯气-氯水体系中存在以下平衡关系:| A. | Cl2(g)+H2O?2H++ClO-+Cl- K=10-10.9 | |
| B. | pH=7.5时,用氯处理饮用水体系中,c(Cl-)+c(HClO)=c(H+)-c(OH-) | |
| C. | 用氯处理饮用水时,pH=6.5时杀菌效果比pH=4.5时好 | |
| D. | 氯处理饮用水时,在夏季的杀菌效果比在冬季好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com