
��ѧ������������ɳ�����չ������ء������й�˵������ȷ����
A��������Ч���ܡ�̫���ܵ����͵綯�������Խ�����л�����β���ŷ�����
B���߿ճ���������̫�������ߣ�������������Ϳչ�����������Ⱦ���壬��������Σ��
C��PM2.5��ʾÿ����������ֱ��С�ڻ����2.5�Ŀ�����ĺ�����PM2.5ֵԽ�ߣ�������ȾԽ����
D���ޡ��顢��ë���ϳ���ά��ȫȼ�ն�ֻ����CO2��H2O���ʶԻ����������Ⱦ
 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�������и�����ѧ�ڵڶ�������������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
������Һ����Һ�У���������Ũ�ȵ�˵����ȷ����
A��һ��Ũ�ȵİ�ˮ��ˮϡ�͵Ĺ����У�c(NH4+)/ c(NH3��H2O)�ı�ֵ��С
B��Ũ�Ⱦ�Ϊ0.1 mol��L��1��Na2CO3��NaHCO3�����Һ�У�c(CO32��) > c(HCO3��)����2c(Na��)��3[c(CO32��)��c(HCO3��)]
C��0.2 mol��L��1�Ĵ��ᣨCH3COOH����Һ��0.1 mol��L��1 NaOH��Һ�������Ϻ�c(CH3COO��) + 2c(OH��) = c(CH3COOH) + 2c(H+)
D�������£���֪��Ksp(AgCl)��1.8��10��10��Ksp(Ag2Cr2O4)��2.0��10��12����Ag2CrO4����Һ�е�c(Ag��)һ��С��AgCl����Һ�е�c(Ag��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡμ���и�����ѧ������⣨һģ����ѧ�Ծ��������棩 ���ͣ������
(10�֣����������飬�׳���˪������ʽAs2O3�������ҵ��ֵ���黯���P��Ҫ���黯ѧ��ʼ���ϡ���Ҳ������ϵĶ���֮һ������ζ�����Ϊ��ɫ��״��ĩ���ʳ���˪��
��1����ɲ���ƽ���л�ѧ����ʽ:
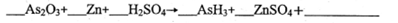
��2��As2O3��������Ӧ����ʾ������������_____________��
A�������� B����ԭ�� C������ D������
��3��������0��2molAsH3 ,��ת�Ƶ��ӵ����ʵ���Ϊ___________mol��
��4���黯��AsH3��һ�ֺ�ǿ�Ļ�ԭ�����������������ڿ�������ȼ�����������������ԣ�д���÷�Ӧ�Ļ�ѧ����ʽ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�������ʡ�绯�и�����һ��ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ��ƶ���
�ۻ�ѧ---ѡ��5���л���ѧ������(15��) (����DMP)��һ�ֳ��õ������ܻ�����������������������ܶ�Ϊ97����ҵ������DMP��������ͼ��ʾ��
(����DMP)��һ�ֳ��õ������ܻ�����������������������ܶ�Ϊ97����ҵ������DMP��������ͼ��ʾ��
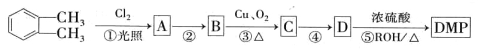
��1������ת��������ȡ����Ӧ���� ��D�ĺ˴Ź��������� ��塣
��2�� ������ ��C�й����ŵ�����Ϊ ��DMP�ķ���ʽΪ ��
������ ��C�й����ŵ�����Ϊ ��DMP�ķ���ʽΪ ��
��3��A��B�Ļ�ѧ����ʽΪ ��
��4��E��D�ķ�����ͬ���칹�壬E������������������FeCl3��Һ����ɫ�����ܷ���������Ӧ���۱�����������ȡ�����������������E����� �֣�д�����������������ʵĽṹ��ʽ ��
��5���� �Ʊ�DMP����һ��;����
�Ʊ�DMP����һ��;����
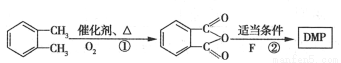
���з�Ӧ�ٻ�������һ�ֲ���ò���������� ����Ӧ���е���һ������ˮ����n(F):n(H2O)=2:1����F�Ľṹ��ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�������ʡ�绯�и�����һ��ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����������Դ�������ֲ��ϣ����Ʒ����ʾ��ͼ���¡������й�˵������ȷ����
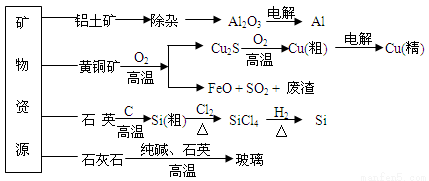
A����ȡ������ͬʱ����CO2���壬��ȡ�ֹ�ʱ���ɵ��������ΪCO
B�������ߴ��衢����ͭ�������Ĺ����ж��漰������ԭ��Ӧ
C���ֹ��Ƹߴ���ʱ���ᴿ���Ȼ�����ö������ķ���
D����ͭ��ұ��ͭʱ������SO2�������������ᣬFeO������ұ������ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ��У�����ڶ����������ۻ�ѧ�Ծ��������棩 ���ͣ������
��12�֣��״�����Ҫ�Ļ�ѧ��ҵ����ԭ�Ϻ�Һ��ȼ�ϡ���ҵ�Ͽ�����CO��CO2������ȼ�ϼ״�����֪�״��Ʊ����йػ�ѧ��Ӧ�Լ��ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ�����±���ʾ��
��ѧ��Ӧ | ƽ�ⳣ�� | �¶ȣ��棩 | |
500 | 800 | ||
��2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
��H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
��3H2(g)+ CO2(g) | K3 | ||
��1����Ӧ���� ������ȡ����ȡ�����Ӧ��
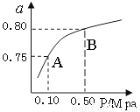
��2��ij�¶��·�Ӧ����H2��ƽ��ת���ʣ�a������ϵ��ѹǿ(P)�Ĺ�ϵ��ͼ��ʾ����ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ��K(A) K(B)�����������������������
��3���ݷ�Ӧ����ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵ����K3= ����K1��K2��ʾ������500�桢2L���ܱ������У����з�Ӧ�ۣ����ijʱ��H2��CO2�� CH3OH��H2O�����ʵ����ֱ�Ϊ6mol��2 mol��10 mol��10 mol����ʱv(��) v(��) ���������=��������
��4��һ���¶��£���3 L�ݻ��ɱ���ܱ������з�����Ӧ�ڣ�
��֪c(CO)�뷴Ӧʱ��t�仯���ߢ���ͼ��ʾ������t0ʱ�̷ֱ�ı�һ�����������ߢ��Ϊ���ߢ�����ߢ�
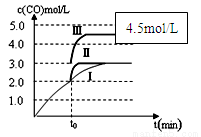
�����ߢ��Ϊ���ߢ�ʱ���ı�������� ��
�����ߢ��Ϊ���ߢ�ʱ���ı�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ��У�����ڶ����������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��NA��ʾ�����ӏ�������ֵ������˵����ȷ����
A�����³�ѹ�£�2.24L ���������������������Һ��ȫ��Ӧת�Ƶĵ�����Ϊ0.1NA
B��25��ʱ��2L0.1mol/L��Na2CO3��Һ�к��е�CO32-����Ϊ0.2 NA
C��ij�ܱ�������ʢ��0.2molSO2��0.1molO2����һ�������³�ַ�Ӧ������SO3������Ϊ0.2 NA
D��30g����ͼ�ȩ�Ļ��������ԭ����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ��ԭ�и�һ��ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���и����������ȷ����
A��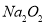 �ĵ���ʽΪ
�ĵ���ʽΪ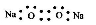
B��16g������ȫȼ�����ɵ�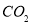 Ϊ11.2L(��״��)
Ϊ11.2L(��״��)
C���ڵ�ԭ���У�������Ϊ7����������һ��Ϊ7
D��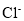 �Ľṹʾ��ͼΪ
�Ľṹʾ��ͼΪ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ����������У������ѧ�����������ۻ�ѧ�Ծ��������棩 ���ͣ������
��15�֣����Ͼ�п�̵�ش����õ����̻������Ժ��̻����Ϊԭ���Ʊ���п���������Ҫ������ͼl��ʾ��
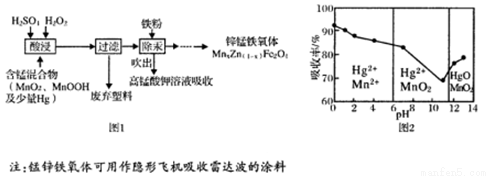
��ش��������⣺
��1��MnOOH�У���Ԫ�صĻ��ϼ�Ϊ____��
��2������п�̸ɵ�صĵ����ΪKOH��Mn02����ĵ�巴Ӧ����ʽΪ ��
��3�����ʱ��MnO2 ��H2SO4��H2O2��Ӧ�����ӷ���ʽΪ ��
��4���ڲ�ͬpH�£�KMnO4��Һ��Hg�������ʼ���Ҫ������ͼ2��ʾ��
��pH��Hg�����ʵ�Ӱ������� ��
����ǿ���Ի�����Hg�������ʸߵ�ԭ������� ��
��5���̻����·��������̻�������һ������ϡ���ᡢϡ���ᣬ�����Ͻ�����������Ϊֹ������Ҫ��ӦΪ��2MnOOH+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2��+6H2O
�ٵ�1molMnO2�μӷ�Ӧʱ������_____mol���ӷ���ת�ơ�
��MnOOH��Ũ�����ڼ���������Ҳ�ɷ�����Ӧ����д���䷴Ӧ�Ļ�ѧ����ʽ��_________________��
����֪��Ksp(MnCO3)=2.3��10-11��Ksp(Mn��OH��2))=2.1��10-13,���Ʊ�MnCO3,ѡ�õļ��Ϸ�ʽ��______(����ĸ)��ԭ����___________________________________��
a����MnSO4��Һ��Na2CO3��Һͬʱ���뵽��Ӧ������
b����MnSO4��Һ�������뵽ʢ��Na2CO3��Һ�ķ�Ӧ������
c����Na2CO3��Һ�������뵽ʢ��MnSO4��Һ�ķ�Ӧ������
d���������ַ��������Ƶ�MnCO3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com