
| A. | 增加O2的浓度 | B. | 增加SO2的浓度 | C. | 使用催化剂 | D. | 增加SO3的量 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的最外层电子数相同 | B. | 它们的原子半径相差不大 | ||
| C. | 它们都是金属元素 | D. | 它们的最高化合价相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、石油、天然气等燃料属不可再生能源 | |
| B. | 煤、石油、水煤气可从自然界直接获取,属一级能源 | |
| C. | 太阳能是一级能源、新能源、可再生能源 | |
| D. | 潮汐能来源于月球引力做功 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 为体现“绿色奥运”、“科技奥运”的理念,中国将在2008年北京奥运会时推出国产燃料电池汽车,作为马拉松领跑车和拍摄车,该车装有“绿色心脏”--质子交换膜燃料电池.下图是某科技杂志登载的该电池原理示意图.下列叙述正确的是( )
为体现“绿色奥运”、“科技奥运”的理念,中国将在2008年北京奥运会时推出国产燃料电池汽车,作为马拉松领跑车和拍摄车,该车装有“绿色心脏”--质子交换膜燃料电池.下图是某科技杂志登载的该电池原理示意图.下列叙述正确的是( )| A. | 工作时,“阳极”周围溶液的酸性增强 | |
| B. | 氢气在电极上发生还原反应 | |
| C. | 图中标出的“阴极”实际是原电池的负极 | |
| D. | 工作过程中,质子(H+)从“阴极”一边透过质子交换膜移动到“阳极”一边与OH-反应生成水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
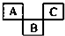 如图是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等.
如图是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等.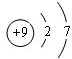 ;B的最高价氧化物对应的水化物的化学式为H2SO4.
;B的最高价氧化物对应的水化物的化学式为H2SO4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 金属 | 冶炼方法 | |
| A | 钾、钙 | Ⅳ |
| B | 钠、铝 | Ⅲ |
| C | 铜、铁 | Ⅰ |
| D | 银、汞 | Ⅱ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com