
����Ŀ���ҹ��Ǹ������������������Ϊ�����һ����¯��������Ϊ�ձ������������
��1��I����֪��Ӧ ![]() Fe2O3��s��+CO��g��
Fe2O3��s��+CO��g�� ![]() Fe��s��+CO2��g����H=��23.5kJmol��1 �� �÷�Ӧ��1000���ƽ�ⳣ������4����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol��Ӧ����l0min��ﵽƽ�⣮ ��CO��ƽ��ת����=
Fe��s��+CO2��g����H=��23.5kJmol��1 �� �÷�Ӧ��1000���ƽ�ⳣ������4����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol��Ӧ����l0min��ﵽƽ�⣮ ��CO��ƽ��ת����=
�������CO��ƽ��ת���ʣ��ٽ�Fe2O3��ת�����ɲ�ȡ�Ĵ�ʩ�� ��
a����߷�Ӧ�¶�
b������Ӧ��ϵ��ѹǿ
c��ѡȡ���ʵĴ���
d����ʱ���ջ��Ƴ�����CO2
e�������ʯ��ʹ����ƽ���������ֽӴ�
��2����¯���������ķ����е�CO�ɽ��л��գ�ʹ����һ�������º�H2��Ӧ�Ʊ��״���CO��g��+2H2��g��CH3OH��g���������ͼʾ�ش��������⣺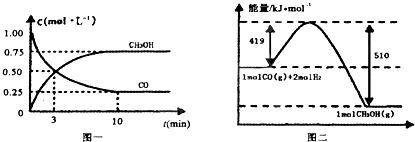
�ٴӷ�Ӧ��ʼ��ƽ�⣬��H2Ũ�ȱ仯��ʾƽ����Ӧ����v��H2��= ��
����֪������ȼ����286kJ/mol����д���״����岻���ȼ�յ��Ȼ�ѧ����ʽ ��
�������¶Ⱥ�������ͬ�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ���÷�Ӧ�ﵽƽ�ⅼ���й��������±���
���� | ��Ӧ��Ͷ����� | ��Ӧ��� | CH3OH��Ũ�� | �����仯 |
�� | 1mol CO��2mol H2 | ��1 | c1 | �ų�Q1kJ���� |
�� | 1mol CH3OH | ��2 | c2 | ����Q2kJ���� |
�� | 2mol CO��4mol H2 | ��3 | c3 | �ų�Q3kJ���� |
�����й�ϵ��ȷ����
A��c1=c2B.2Q1=Q3C.2��1=��3D����1+��2=1E���÷�Ӧ������1mol CH3OH����ų���Q1+Q2��kJ������
���𰸡�
��1��60%��d
��2��0.15mol/��L?min����CH3OH��g��+O2��g��=2H2O��l��+CO��g����H=��481kJ/mol��ADE
���������⣺��1��I����ƽ��ʱCO�����ʵ����仯Ϊnmol���� ![]() Fe2O3��s��+CO��g��
Fe2O3��s��+CO��g�� ![]() Fe��s��+CO2��g��
Fe��s��+CO2��g��
��ʼ��mol����1 1
�仯��mol����n n
ƽ�⣨mol����1��n n+1
���� ![]() =4�����n=0.6����CO��ƽ��ת����Ϊ
=4�����n=0.6����CO��ƽ��ת����Ϊ ![]() ��100%=60%��
��100%=60%��
���Դ��ǣ�60%����a���÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ����߷�Ӧ�¶ȣ�ƽ�����淴Ӧ�ƶ���CO��ƽ��ת���ʽ��ͣ���a����b����Ӧǰ����������ʵ������䣬��С�������ݻ�������ѹǿƽ�ⲻ�ƶ���CO��ƽ��ת���ʲ��䣬��b����c��������ʵĴ�����ƽ�ⲻ�ƶ�����c����d���Ƴ�����CO2 �� ƽ��������Ӧ�ƶ���CO��ƽ��ת��������d��ȷ��e�������ʯ��ʹ����ƽ���������ֽӴ������Լӿ췴Ӧ���ʣ���ƽ�ⲻ�ƶ�����e�������Դ��ǣ�d����2�������ͼ��֪���ﵽƽ��ʱ�״���Ũ�ȱ仯Ϊ0.75mol/L����v��CH3OH��= ![]() =0.075mol/��L��min��������֮�ȵ��ڻ�ѧ������֮�ȣ�v��H2��=2v��CH3OH��=0.15mol/��Lmin�������Դ��ǣ�0.15mol/��Lmin������������ȼ����Ϊ286kJ/mol����2H2��g��+O2��g��=2H2O��l����H=��572kJ/mol �٣���ͼ�ɵã�CO��g��+2H2��g��CH3OH��g����H=��91kJ/mol �ڣ����ݸ�˹���ɣ��٩��ڿɵã�CH3OH��g��+O2��g��=2H2O��l��+CO��g������״����岻���ȼ�յ��Ȼ�ѧ����ʽ��CH3OH��g��+O2��g��=2H2O��l��+CO��g����H=��481kJ/mol�����Դ��ǣ�CH3OH��g��+O2��g��=2H2O��l��+CO��g����H=��481kJ/mol����A���ס�������ȫ��Чƽ�⣬ƽ��ʱ����ֵ�Ũ����ȣ�����ƽ��ʱ�״���Ũ��c1=c2 �� ��A��ȷ��B���������ȣ���ЧΪ�ڼ�ƽ��Ļ������ټ���1mol CO��2mol H2 �� ѹǿ����ƽ��������Ӧ�����ƶ������з�Ӧ���ת���ʴ��ڼף����вμӷ�Ӧ��CO���ڼ��е�2������2Q1��Q3 �� ��B����C���������ȣ���ЧΪ�ڼ�ƽ��Ļ������ټ���1mol CO��2mol H2 �� ѹǿ����ƽ��������Ӧ�����ƶ������з�Ӧ���ת���ʴ��ڼף�������1mol CO��2mol H2��ת����С�ڼ��е�ת���ʣ���2��1����3 �� ��C����D������������ȫ��Чƽ�⣬ƽ��ʱ��Ӧ����ֵĺ�����ȫ��ͬ��CO��ת����Ϊ��1 �� ��ƽ��ʱCO�����ʵ���Ϊ��1����1��mol������ƽ��ʱ�״���ת����Ϊ��2 �� ����ƽ��ʱCO�����ʵ���Ϊ��2mol���ʣ�1����1��=��2 �� �����æ�1+��2=1����D��ȷ��E����ƽ��ʱCO�����ʵ���Ϊnmol��CO��g��+2H2��g��CH3OH��g���ķ�Ӧ�ȡ�H=��QkJ/mol����Q1=��1��n��Q��Q2=nQ��������Q=Q1+Q2 �� ��1mol CH3OH����ų���Q1+Q2��kJ��������E��ȷ�����Դ��ǣ�ADE��
=0.075mol/��L��min��������֮�ȵ��ڻ�ѧ������֮�ȣ�v��H2��=2v��CH3OH��=0.15mol/��Lmin�������Դ��ǣ�0.15mol/��Lmin������������ȼ����Ϊ286kJ/mol����2H2��g��+O2��g��=2H2O��l����H=��572kJ/mol �٣���ͼ�ɵã�CO��g��+2H2��g��CH3OH��g����H=��91kJ/mol �ڣ����ݸ�˹���ɣ��٩��ڿɵã�CH3OH��g��+O2��g��=2H2O��l��+CO��g������״����岻���ȼ�յ��Ȼ�ѧ����ʽ��CH3OH��g��+O2��g��=2H2O��l��+CO��g����H=��481kJ/mol�����Դ��ǣ�CH3OH��g��+O2��g��=2H2O��l��+CO��g����H=��481kJ/mol����A���ס�������ȫ��Чƽ�⣬ƽ��ʱ����ֵ�Ũ����ȣ�����ƽ��ʱ�״���Ũ��c1=c2 �� ��A��ȷ��B���������ȣ���ЧΪ�ڼ�ƽ��Ļ������ټ���1mol CO��2mol H2 �� ѹǿ����ƽ��������Ӧ�����ƶ������з�Ӧ���ת���ʴ��ڼף����вμӷ�Ӧ��CO���ڼ��е�2������2Q1��Q3 �� ��B����C���������ȣ���ЧΪ�ڼ�ƽ��Ļ������ټ���1mol CO��2mol H2 �� ѹǿ����ƽ��������Ӧ�����ƶ������з�Ӧ���ת���ʴ��ڼף�������1mol CO��2mol H2��ת����С�ڼ��е�ת���ʣ���2��1����3 �� ��C����D������������ȫ��Чƽ�⣬ƽ��ʱ��Ӧ����ֵĺ�����ȫ��ͬ��CO��ת����Ϊ��1 �� ��ƽ��ʱCO�����ʵ���Ϊ��1����1��mol������ƽ��ʱ�״���ת����Ϊ��2 �� ����ƽ��ʱCO�����ʵ���Ϊ��2mol���ʣ�1����1��=��2 �� �����æ�1+��2=1����D��ȷ��E����ƽ��ʱCO�����ʵ���Ϊnmol��CO��g��+2H2��g��CH3OH��g���ķ�Ӧ�ȡ�H=��QkJ/mol����Q1=��1��n��Q��Q2=nQ��������Q=Q1+Q2 �� ��1mol CH3OH����ų���Q1+Q2��kJ��������E��ȷ�����Դ��ǣ�ADE��
�����㾫�����������⣬������Ҫ�˽⻯ѧƽ��״̬���ʼ�����(��ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч��)����Ҫ���ջ�ѧƽ��ļ���(��Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%)�����֪ʶ���Ǵ���Ĺؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƻ������һ�ֳ������л�������ṹ��ʽΪ![]() ��
��
��1��ƻ������������������ŵ�������_______________��
��2��ƻ������ܷ����ķ�Ӧ��________(�����)��
�ټӳɷ�Ӧ ��������Ӧ �ۼӾ۷�Ӧ ��������Ӧ ����ȥ��Ӧ ��ȡ����Ӧ
��3������A  �����Ҷ�����Ӧ���ɰ�Ԫ��������д���˹��̵Ļ�ѧ����ʽ��______________________________________________��
�����Ҷ�����Ӧ���ɰ�Ԫ��������д���˹��̵Ļ�ѧ����ʽ��______________________________________________��
��4��д��ƻ������Ũ��������������ᷴӦ�Ļ�ѧ����ʽ_______________________����Ӧ����Ϊ_________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ʵļ���˵������ȷ���ǣ� ��
A.�����Ȼ�����Һ�а�ɫ�������ɣ��ټ�ϡ���ᣬ��������ʧ��һ������SO ![]()
B.�۲��Ԫ����ɫ��Ӧ�IJ����ǣ�����˿����ϡ������ϴ�Ӻ���������ɫ��Ȼ�����ò�˿պȡ�����Ȼ��أ�����ú���ƵĻ����Ͻ������գ�����ɫ�ܲ������й۲�
C.����Һ����NaOH��Һ�����ȣ�����ʹʪ��ĺ�ɫʯ����ֽ�������������ɣ���ԭ��Һ��һ������NH ![]()
D.����Һ�����Ȼ�����Һ�а�ɫ�������ɣ��ټ������������ʧ�Ҳ�����ɫ��ζ�����壬�����Һ��һ������CO ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧ����˵����ȷ���� ( )
A. ���ɵ��ʷ��ӵ���һ�����й��ۼ�
B. �ɷǽ���Ԫ����ɵĻ����ﲻһ���ǹ��ۻ�����
C. �Ǽ��Լ�ֻ������˫ԭ�ӷ�����
D. ��ͬԪ����ɵĶ�ԭ�ӷ�����Ļ�ѧ��һ���Ǽ��Լ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У���ȷ���ǣ� ��
A. ��֬���ͺ�֬��֮�֣������͡����͡����Ͷ�������֬
B. ��Ȼ��֬û�й̶����ۡ��е�
C. ������ˮ����Һ���м�������Cu��OH��2��Һ�����ȵ����ڣ���֤ˮ�����Ϊ������
D. ����������Ԫ�س�����ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�ϴ�ý[��Ҫ�ɷ�Ϊ����̿��ZnO��FeO����CH3COO��2Zn]����ȡ����п�����ʵ�鲽����ͼ��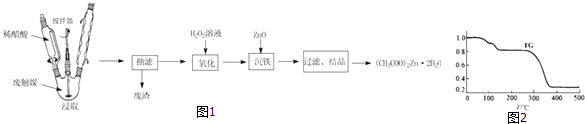
��1����ȡʱ����������ƿ�м���ϴ�ý��ϡ���ᣬ��������ƿ���Ȳ�ͬʱ������������Ŀ���� ��
��2�����Ƚ��ϴ�ý������¯��ͨ����500�洦��һ��ʱ�䣬�����ʻ�����ߣ���ԭ���� �� ����ʱ�õĹ��������������� ��
��3������ͼ�м���H2O2��Ŀ���� ��
��4�����þ��壨CH3COO��2Zn2H2O���ط�����TG/%=������Ʒ��ʣ������/������Ʒ����ʼ����������ͼ2�������ױ����ֽ�������Σ���200��C������ȥ�����ӽᾧˮ���γɵģ�CH3COO��2Zn��242��C���ڣ�370��C��ȫ�ֽ�ΪZnOͬʱ����CO2��һ�ֺ���������˴Ź�������ֻ��1��壩����CH3COO��2Zn�ֽ���������п�ķ�Ӧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£�CO��CH4ȼ�յ��Ȼ�ѧ����ʽ�ֱ�Ϊ 2CO��g��+O2��g���T2CO2��g����H=��566kJmol��1
CH4��g��+2O2��g���TCO2��g��+2H2O��l����H=��890kJmol��1
��1mol CO��g����3mol CH4��g����ɵĻ�����������������³��ȼ�գ��ָ��������ͷŵ�����Ϊ�� ��
A.2912kJ
B.2953kJ
C.3236Kj
D.3867kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ԭ�ϻ��ƳɵIJ�Ʒ�У������������Խ�����������(����)
A.������ϩ��Ь
B.��ľ����
C.���г���̥
D.����ϩ����Ĥ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com