
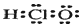
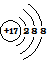

| A. | (2)(5) | B. | (1)(6) | C. | (4)(7) | D. | (3)(4) |
分析 (1)次氯酸为共价化合物,氯原子和氧原子都达到8电子稳定结构;
(2)Cl-的核内有17个质子,核外有18个电子;
(3)二氧化硅是原子构成的化合物;
(4)CO2分子中碳原子最外层有4个电子,形成4个共价键;氧原子最外层有6个电子,形成2个共价键,为直线型结构;
(5)熔化时NaHSO4的时候,只电离出钠离子与硫酸氢根离子;
(6)结构简式应体现官能团-COOH;
(7)原子符号zAX,X代表元素符合,z代表质子数,A代表质量数.
解答 解:(1)次氯酸的电子式中O和Cl要符合8电子结构,其电子式为: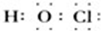 ,故(1)错误;
,故(1)错误;
(2)Cl-是由氯原子得一个电子形成的,故核内有17个质子,核外有18个电子,结构示意图为: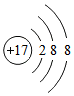 ,故(2)正确;
,故(2)正确;
(3)二氧化硅是原子构成的化合物,不存在二氧化硅分子,故(3)错误;
(4)二氧化碳为直线型分子,碳原子、氧原子在一条直线上,二氧化碳存在2个C=O,是直线型结构:球棍模型: ,故(4)错误;
,故(4)错误;
(5)熔化时只电离出钠离子与硫酸氢根离子,NaHSO4的电离方程式为:NaHSO4═Na++HSO4-,故(5)正确;
(6)结构简式应体现官能团-COOH,则乙酸的结构简式为CH3COOH,故(6)错误;
(7)质量数为37的氯原子符合为1737Cl,故(7)错误,
故选A.
点评 本题考查了化学用语的判断,属于基础知识的考查,题目难度中等,注意掌握常见有机物的表示方法,试题考查了学生规范答题的能力.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验内容 | 实验目的 | |
| A | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中含有SO42- |
| B | 向 AgCl和水的混合物滴加KI的溶液,产生黄色沉淀 | 验证溶解度AgI小于AgCl |
| C | 淀粉和稀硫酸混合加热后,加新制Cu(OH)2悬浊加热至沸腾 | 检验淀粉是否水解完全 |
| D | 向NaOH溶液中滴加FeCl3饱和溶液 | 制备Fe(OH)3胶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | |
| B. | 在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液pH<7 | |
| C. | 若1mL pH=1的盐酸与100mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 | |
| D. | 1.0×10-3mol•L-1盐酸的pH=3.0;1.0×10-8mol•L-1盐酸的pH=8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
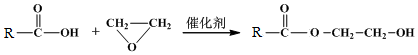
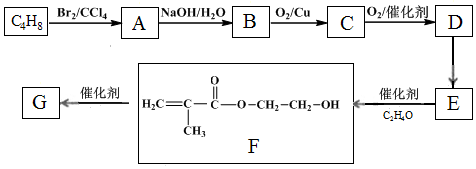
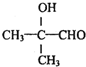 .
.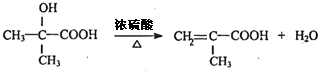 .
.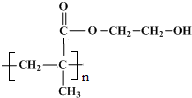 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中 | |
| B. | 容量瓶刚用蒸馏水洗净,没有烘干 | |
| C. | 定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切 | |
| D. | 定容时俯视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作、现象 | 解释 | |
| A | 把生铁放置于潮湿的空气中,铁表面有一层红棕色的斑点 | 铁在潮湿的空气中易生成Fe(OH)3 |
| B | 向KI淀粉溶液中加入FeCl3溶液,溶液变蓝 | Fe3+能与淀粉发生显色反应 |
| C | 新制Fe(OH)2露置于空气中一段时间,白色物质变成了红褐色 | 说明Fe(OH)2易被O2氧化成Fe(OH)3 |
| D | 向稀硝酸中加入少量铁粉,有气泡产生 | 说明Fe置换出硝酸中的氢,生成了氢气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| B. | 常温下,将稀CH3COONa溶液加水稀释后,溶液中n(H+)•n(OH-)不变 | |
| C. | 标准状况下,5.6L由CH4与C2H4组成的混合气体中含有的氢原子数目为6.02×1023 | |
| D. | 一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3KJ,则其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6KJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com