
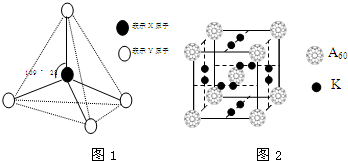
 现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图1所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.工业上利用单质A的同素异形体能与B物质发生置换反应,制取单质G的粗产品.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.
现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图1所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.工业上利用单质A的同素异形体能与B物质发生置换反应,制取单质G的粗产品.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.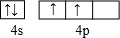 .
.分析 A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有正四面体结构或结构单元,D是阳离子,故D为NH4+;C、D、E、F含有相等的电子数,故电子数为10,D与F的组成元素相同,故F为NH3;由E构成的物质常温下呈液态,故E为H2O;C、E、F的晶体类型相同,属于分子晶体,故C为CH4;A、B的晶体类型相同,单质A的同素异形体能与B物质发生置换反应,A为金刚石,B为二氧化硅,G为Si.
解答 解:A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有正四面体结构或结构单元,D是阳离子,故D为NH4+;C、D、E、F含有相等的电子数,故电子数为10,D与F的组成元素相同,故F为NH3;由E构成的物质常温下呈液态,故E为H2O;C、E、F的晶体类型相同,属于分子晶体,故C为CH4;A、B的晶体类型相同,单质A的同素异形体能与B物质发生置换反应,A为金刚石,B为二氧化硅,G为Si.
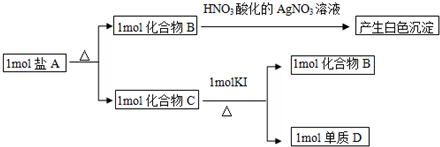
(1)与A同主族的第四周期元素处于第四周期IVA族,基态原子的价电子排布图为 ,故答案为:
,故答案为: ;
;
(2)D为NH4+,中心原子J为N,中N原子价层电子对数为4,杂化类型为sp3杂化,F为NH3,易溶于原因是氨分子与水分子间形成氢键,
故答案为:sp3;氨分子与水分子间形成氢键;
(3)晶胞中C60分子数目为8×$\frac{1}{8}$+1=2,K原子数目为2×6×$\frac{1}{2}$=6,故化学式为:K3C60,
同一周期,从左到右,电负性逐渐增大,同一主族,从上到下,电负性逐渐减小,因此,原子电负性由大到小的顺序是:N>C>Si,
每个硅形成的这3个键中,必然有1个双键,这样每个硅原子最外层才满足8电子稳定结构.显然,双键数应该是Si原子数的一半,而每个双键有1个π键,显然π键数目为30,则1mol G60分子中π键的数目为 1.806×1025,
故答案为:K3C60;N>C>Si;1.806×1025;
(4)上述A-F这六种物质或粒子的组成元素中处于同一周期的三种元素为C、N、O,同周期随原子序数增大,越大第一电离能呈增大趋势,氮元素2p能级为半满稳定状态,第一电离能高于同周期相邻元素的,故这三种元素第一电离能由大到小的顺序:N>O>C,
故答案为:N>O>C;
(5)CoCl3•5F•H2O中的中心离子钴离子在基态时核外电子排布式为1s22s22p63s23p63d44s2,CoCl3•5NH3•H2O水溶液加AgNO3于该化合物溶液中,有AgCl沉淀生成,说明外界离子有Cl-,过滤后再加AgNO3溶液于滤液中无变化,但加热至沸腾有AgCl沉淀生成,说明配体中含有Cl-,且其质量为第一次沉淀量的二分之一,说明外界离子有Cl-与配体Cl-之比为2:1,该配离子化学式可能为[CoCl(NH3)5]Cl2•H2O,
故答案为:1s22s22p63s23p63d44s2;[CoCl(NH3)5]Cl2•H2O.
点评 本题是对物质结构与性质的考查,涉及微粒推断、核外电子排布、配合物、晶胞计算等,利用均摊法进行晶胞有关计算,理解配合物中内界与外界性质的不同,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 需要用托盘天平称量NaOH固体的质量为1.92g | |
| B. | 将NaOH固体在小烧杯中加水溶解后立即倒入容量瓶中并进行定容 | |
| C. | 在容量瓶中定容时俯视容量瓶刻度线会使溶液浓度偏高 | |
| D. | 定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
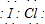 ,该化合物中显正价的是I元素.
,该化合物中显正价的是I元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H${\;}_{2}^{18}$O中投入Na2O2固体:2H${\;}_{2}^{18}$O+2O${\;}_{2}^{2-}$═4OH-+18O2↑ | |
| B. | 向0.1 mol•L-1、pH=1的NaHA溶液中加入NaOH溶液:H++OH-═H2O | |
| C. | 以金属银为阳极电解饱和硫酸铜溶液:Cu2++2H2O═2Cu+O2↑+4H+ | |
| D. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液SO42-使完全沉淀:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
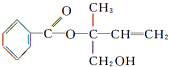
| A. | X的分子式为C12H16O3 | |
| B. | 可用酸性高锰酸钾溶液区分苯和X | |
| C. | 若单键可以旋转,有机物X中一定在同一平面上的碳原子数为8 | |
| D. | 在Ni作催化剂的条件下,1 mol X最多只能与1 mol H2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
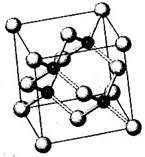 N、P、As、Ga、Cr等元素化合物种类繁多,具有重要的研究价值和应用价值.请回答下列问题:
N、P、As、Ga、Cr等元素化合物种类繁多,具有重要的研究价值和应用价值.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入水中 Cl2+H2O?H++Cl-+HClO | |
| B. | 甲烷的完全燃烧CH4(g)+2O2(g)$\frac{\underline{\;点燃\;}}{\;}$ CO2(g)+2H2O(l)△H<0 | |
| C. | 冰醋酸加入水中CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 铁与水蒸气反应 2Fe+3H2O$\frac{\underline{\;高温\;}}{\;}$ Fe2O3+3H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12种 | B. | 11种 | C. | 9种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1 mol碳酸钠晶体中含有CO32-的个数为0.1NA | |
| B. | 标准状况下22.4 L H2O所含分子数为NA | |
| C. | 1 L 0.5 mol•L-1 CH3COOH溶液中,CH3COO-的个数为0.5NA | |
| D. | 在NO、NO2的混合气体22.4 L中,含有的氮原子数为NA个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com