
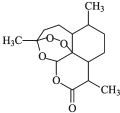
 2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是( )
2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是( )| A. | 分子式为C15H20O5 | B. | 具有较强的还原性 | ||
| C. | 易溶于水,乙醇和乙醚 | D. | 氧原子的化合价由-1和-2 |
分析 A.根据结构简式确定分子式;
B.该物质中具有过氧键,具有过氧化物的性质;
C.该物质中不含亲水基,含有憎水剂;
D.该分子中醚键、酯基中的O元素化合价为-2价,过氧键中O元素化合价为-1价.
解答 解:A.根据结构简式知,分子式为C15H22O5,故A错误;
B.该物质中具有过氧键,具有过氧化物的性质,具有强氧化性,故B错误;
C.该物质中不含亲水基,含有憎水剂,所以不易溶于水,易溶于乙醇和乙醚,故C错误;
D.该分子中醚键、酯基中的O元素化合价为-2价,过氧键中O元素化合价为-1价,故D正确;
故选D.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,涉及分子式确定、溶解性、化合价等知识点,侧重考查学生分析判断及知识迁移能力,易错选项是D.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )的酸性废水,可利用微生物电池法除去,其原理如图2所示
)的酸性废水,可利用微生物电池法除去,其原理如图2所示 -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-
-OH+Cl-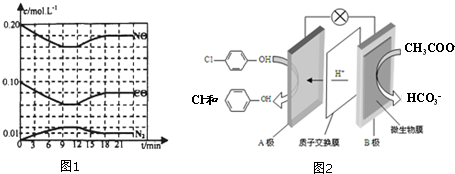
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
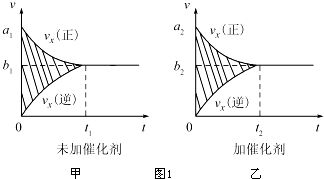
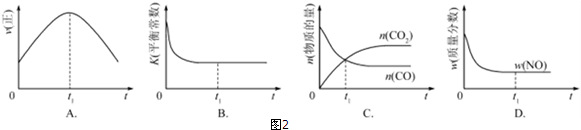
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
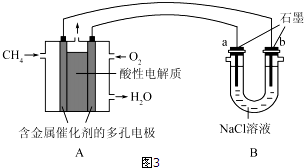
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铝与Fe2O3发生铝热反应后固体物质质量不变 | |
| B. | Na、Al、Cu可以分别用电解冶炼法、热还原法和热分解法得到 | |
| C. | 过量的铜与浓硝酸反应可生成NO | |
| D. | 由于铝元素和铁元素都有+3价,由2Al+6HCl2═AlCl3+3H2↑可知:2Fe+6HCl2═FeCl3+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度不再变化 | |
| B. | 混合气体的颜色不变化 | |
| C. | 混合气体中NO2、NO、O2的物质的量之比为2:2:1 | |
| D. | 单位时间生成2n mol NO,同时消耗2n mol NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间 | c(CO)/mol/L | c(H2)/mol/L | c(CH3OH)/mol/L |
| 起始 | 1 | 3 | 0 |
| 第2min | 0.8 | 2.6 | 0.2 |
| 第4min | 0.4 | 1.8 | 0.6 |
| 第6min | 0.4 | 1.8 | 0.6 |
| A. | 第4 min至第6 min该化学反应处于平衡状态 | |
| B. | 第2 min时,如果只改变某一条件,则改变的条件可能是降低温度 | |
| C. | 第2 min时,如果只改变某一条件,则改变的条件可能是使用催化剂 | |
| D. | 第6 min时,其他条件不变,如果升高温度,反应速率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com