
| A. | 做“钠与水的反应”实验时.切取绿豆大小的金属钠,用滤纸吸干表面煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象 | |
| B. | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置;下层液体显紫红色;则氧化性:Fe3+>I2 | |
| C. | 测定等浓度的Na2CO3和Na2SO3 溶液的pH;前者pH 比后者的大;则非金属性:S>C | |
| D. | 溴乙烷与 NaOH 溶液共热后,加入AgNO3溶液;未出现淡黄色沉淀;说明溴乙烷没有水解 |
分析 A、应该是将绿豆大小的金属钠放入滴有酚酞的水溶液中;
B、溶液显紫红色,说明生成I2;
C、测定等浓度的Na2CO3和Na2SO3溶液的pH,可知亚硫酸的酸性大于碳酸的酸性;
D、在加入硝酸银溶液之前必须先加入稀硝酸,否则不出现淡黄色沉淀.
解答 解:A、做“钠与水的反应”实验时,切取绿豆大小的金属钠,用滤纸吸干其表面的煤油,放入滴有酚酞的水溶液中,故A错误;
B、溶液显紫红色,说明生成I2,则证明氧化性:Fe3+>I2,故B正确;
C、测定等浓度的Na2CO3和Na2SO3溶液的pH,可知亚硫酸的酸性大于碳酸的酸性,亚硫酸不是最高价含氧酸,不能比较非金属性,故C错误;
D、在加入硝酸银溶液之前必须先加稀硝酸中和未反应的NaOH,防止硝酸银和NaOH反应而干扰溴离子的检验,故D错误;
故选B.
点评 本题考查化学实验评价,为高频考点,涉及氧化性强弱比较、卤代烃中卤元素检验、非金属性强弱比较等知识点,把握实验原理及物质性质是解本题关键,注意实验评价性分析和判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
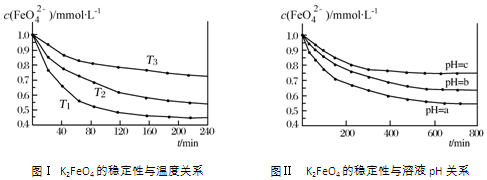
| A. | 由图Ⅰ可知K2FeO4的稳定性随温度的升高而减弱 | |
| B. | 由图Ⅰ可知温度:T1>T2>T3 | |
| C. | 由图Ⅰ可知上述反应△H<0 | |
| D. | 由图Ⅱ可知图中a<c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.1 g 37Cl2含有的中子数为4NA | |
| B. | NA个Al(OH)3胶体粒子的质量为78 g | |
| C. | 7.8 g Na2O2晶体中阴阳离子总数为0.3NA | |
| D. | 标准状况下,2.24 L己烷含有的共价键数为1.9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
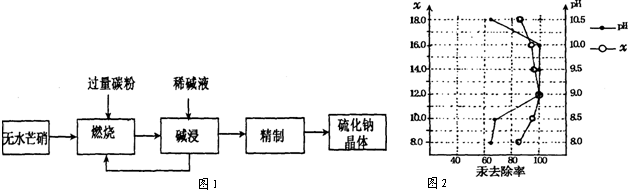
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
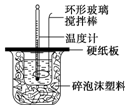 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
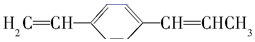 的说法正确的是( )
的说法正确的是( )| A. | 所有原子都在同一平面上 | |
| B. | 最多有4个碳原子在同一直线上 | |
| C. | 有7个碳原子可能在同一直线上 | |
| D. | 最多只能有9个碳原子在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
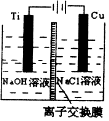 纳米级Cu2O由于具有优良的催化性能而受到关注,表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,表为制取Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$ Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
| 序号 | 0 | 10 | 20 | 30 | 40 | 50 | |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com