
| A、测定同浓度的盐酸、硼酸溶液的导电能力 |
| B、常温下,用pH计测定硼酸钠溶液的pH |
| C、将碳酸钠溶液滴入硼酸溶液中,无明显现象 |
| D、将硼酸溶液稀释2倍后,用pH试纸测定其pH变化 |


科目:高中化学 来源: 题型:
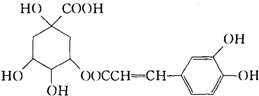 咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示:1mol咖啡鞣酸与NaOH完全反应时可消耗 NaOH物质的量是( )
咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示:1mol咖啡鞣酸与NaOH完全反应时可消耗 NaOH物质的量是( )| A、2 molNaOH |
| B、4 molNaOH |
| C、6 molNaOH |
| D、8 molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁壳轮船在河水中航行比在海水中航行更易被腐蚀 |
| B、常温下,铁易被干燥的氯气腐蚀 |
| C、钢铁发生吸氧腐蚀时,发生的负极反应为02+4e-+2H20═40H- |
| D、为了防止枪炮表面的钢铁被腐蚀,可以在钢铁表面进行烤蓝处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、灼热的铁丝在氯气中燃烧,集气瓶内产生棕黄色烟雾 |
| B、氢气在氯气中燃烧,集气瓶口有白雾 |
| C、钠在氯气中燃烧,集气瓶内产生大量的白色烟雾 |
| D、灼热的铜丝在氯气中燃烧,集气瓶内产生棕红色烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N元素的电负性较大,但N2的化学性质很稳定 |
| B、F2比O2更容易与H2反应 |
| C、HF、HCl、HBr、HI的稳定性逐渐减弱 |
| D、稀有气体一般难发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
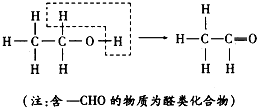
| A、(CH3)3COH |
B、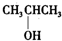 |
C、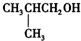 |
| D、CH3CH2CH(CH3)OH. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na和O2 |
| B、NaOH和CO2 |
| C、Na2CO3和HCl |
| D、NaHCO3和NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com