
| X | Y | |||
| z | W | Q |
| A. | Y元素气态氢化物的稳定性大于X元素的气态氢化物 | |
| B. | 形成的简单离子半径:W>Q>Z>X | |
| C. | Q的最高价氧化物对应的水化物酸性最强 | |
| D. | X的最高价氧化物对应的水化物与其氢化物形成的化合物中含有离子键和共价键 |
分析 由短周期元素X、Y、Z、W、Q在元素周期表中的位置,可知X、Y处于第二周期,Z、W、Q处于第三周期,Z元素的简单离子半径在本周期中最小,则Z为Al,可推知X为N、Y为、W为S、Q为Cl.
A.同周期自左而右元素非金属性增强,氢化物稳定性增强;
B.电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大;
C.最高价氧化物对应水化物中高氯酸的酸性最强;
D.X的最高价氧化物对应的水化物与其氢化物形成的化合物为NH4NO3,含有离子键和共价键.
解答 解:由短周期元素X、Y、Z、W、Q在元素周期表中的位置,可知X、Y处于第二周期,Z、W、Q处于第三周期,Z元素的简单离子半径在本周期中最小,则Z为Al,可推知X为N、Y为、W为S、Q为Cl.
A.非金属性Y(O)>X(N),故氢化物稳定性:Y>X,故A正确;
B.电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:S2->Cl->N3->Na+,故B错误;
C.Q的最高价氧化物对应的水化物为高氯酸,其酸性最强,故C正确;
D.X的最高价氧化物对应的水化物与其氢化物形成的化合物为NH4NO3,含有离子键和共价键,故D正确.
故选:B.
点评 本题考查结构性质位置关系应用,关键是掌握离子半径大小比较,熟练掌握元素周期表的结构与元素周期律.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 用加热蒸发K2CO3溶液的方法获得K2CO3晶体 | |
| B. | 用Na2S溶液和Al2(SO4)3溶液反应制取Al2S3固体 | |
| C. | 用Na2S溶液和CuSO4溶液反应无法制取CuS固体 | |
| D. | 加热MgCl2溶液制取MgCl2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
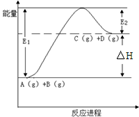
| A. | 该反应是放热反应 | |
| B. | 加入催化剂后,反应加快,△H减小 | |
| C. | 反应物的总键能小于生成物的总键能 | |
| D. | 反应达到平衡时,升高温度,A的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ○ |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷(丙烯),酸性高锰酸钾溶液 | B. | 甲烷(乙炔),溴的四氯化碳溶液 | ||
| C. | 溴苯(溴),苯 | D. | 硝基苯(硝酸),苯和浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa与O2完全反应生成Na2O2和Na2O的混合物,转移电子的总数为NA | |
| B. | 室温下,31.0g白磷中含有的共价键数目为1.5NA | |
| C. | 常温常压下,17g甲基(-14CH3)含有的电子数为9NA | |
| D. | 常温下,1.0L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 1054 0 | 13630 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com