

| A. | 50 mL该H2SO4中加入足量的铜片并加热,被还原的H2SO4的物质的量为0.46 mol | |
| B. | 稀释该硫酸时应把水倒入硫酸中,边倒边搅拌 | |
| C. | 该硫酸试剂的物质的量浓度为18.4 mol/L | |
| D. | 标准状况下2.7g Al与足量的该硫酸反应可得到H2 3.36L |
分析 该浓硫酸的物质的量浓度为:c=$\frac{1000×1.84×98%}{98}$mol/L=18.4molL,
A.浓硫酸变成稀硫酸后反应停止,则反应生成二氧化硫的物质的量减小,被还原的硫酸减少;
B.稀释浓硫酸时,应该将浓硫酸缓缓倒入水中,顺序不能颠倒;
C.根据分析可知该浓硫酸的物质的量浓度.
D.常温下铝与浓硫酸发生钝化现象.
解答 解:该浓硫酸的物质的量浓度为:c=$\frac{1000×1.84×98%}{98}$mol/L=18.4molL,
A.50 mL该H2SO4中还原硫酸的物质的量为:18.4mol/L×0.05L=0.92mol,由于随着反应的进行,浓硫酸变成稀硫酸后反应停止,则被还原的硫酸的物质的量小于0.46mol,故A错误;
B.浓硫酸密度大于水,且稀释过程中放出大量热,若稀释该硫酸时应把水倒入硫酸中,会导致酸溶液飞溅,易发生危险,应该将浓硫酸盐玻璃杯缓缓倒入水中,故B错误;
C.根据计算可知,该浓硫酸的物质的量浓度为18.4molL,故C正确;
D.该硫酸为浓硫酸,常温下铝与浓硫酸发生钝化现象,且反应生成的不是氢气,故D错误;
点评 本题考查了物质的量浓度的计算与应用,题目难度中等,明确物质的量浓度与溶质质量分数的关系为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 任何油脂在碱性条件下水解都能生成甘油 | |
| B. | 蔗糖水解前后均可发生银镜反应 | |
| C. | 不同的单糖含有的官能团相同 | |
| D. | 向蛋白质中加入CuSO4溶液发生盐析 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打溶液电离:NaHCO3═Na++H++CO32- | |
| B. | 明矾净水原理:Al3++3H2O?Al(OH)3↓+3H+ | |
| C. | 稀醋酸呈酸性:CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 重晶石的电离:BaSO4?Ba2++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液滴入沸水中制备Fe(OH)3胶体:$Fe_{\;}^{3+}$+$3OH_{\;}^-$═Fe(OH)3(胶体) | |
| B. | Cu溶于稀硝酸:Cu+2$H_{\;}^+$+$NO_3^-$═$Cu_{\;}^{2+}$+NO2↑+H2O | |
| C. | 向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| D. | 氯气溶于水:Cl2+H2O═2H++$Cl_{\;}^-$+$ClO_{\;}^-$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要含有金属元素的化合物一定是离子化合物 | |
| B. | 全部元素都由非金属元素构成的化合物一定是共价化合物 | |
| C. | 离子化合物一定是电解质 | |
| D. | 共价化合物一定是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
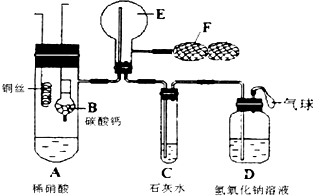 为了证明铜和稀硝酸反应产生一氧化氮气体,某学校学生实验小组设计了一个实验,其装置如图所示(加热装置与固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是可控制气体流向,用于鼓入空气的双连打气球.
为了证明铜和稀硝酸反应产生一氧化氮气体,某学校学生实验小组设计了一个实验,其装置如图所示(加热装置与固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是可控制气体流向,用于鼓入空气的双连打气球.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.8 | B. | 11.6 | C. | 23.2 | D. | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇完全燃烧生成二氧化碳和水 | |
| B. | 乙醇能与水任意比混溶 | |
| C. | 乙醇在铜催化下可被氧化 | |
| D. | 0.1mol乙醇与足量的钠反应只能生成0.1g氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com