
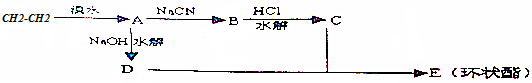
分析 乙烯和溴发生加成反应生成A,A为BrCH2CH2Br,A碱性条件下发生水解反应生成D为HOCH2CH2OH,1,2-二溴乙烷与NaCN发生取代反应生成B为NCCH2CH2CN,B水解得到C为HOOCCH2CH2COOH,C与D发生酯化反应生成环酯E为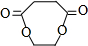 ,据此分析解答.
,据此分析解答.
解答 解:乙烯和溴发生加成反应生成A,A为BrCH2CH2Br,A碱性条件下发生水解反应生成D为HOCH2CH2OH,1,2-二溴乙烷与NaCN发生取代反应生成B为NCCH2CH2CN,B水解得到C为HOOCCH2CH2COOH,C与D发生酯化反应生成环酯E为 ,
,
通过以上分析知,A、B、C、D结构简式分别为BrCH2CH2Br、NCCH2CH2CN、HOOCCH2CH2COOH、HOCH2CH2OH,答:A、B、C、D结构简式分别为BrCH2CH2Br、NCCH2CH2CN、HOOCCH2CH2COOH、HOCH2CH2OH.
点评 本题考查有机物推断,侧重考查学生分析推断及知识迁移能力,根据乙烯结构、反应条件结合题给信息进行推断,正确理解题给信息中物质断键和成键方式是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 离子键就是使阴、阳离子结合成化合物的静电引力 | |
| B. | 含有离子键的化合物一定是离子化合物 | |
| C. | 所有金属与所有非金属之间都能形成离子键 | |
| D. | 在化合物Na2O2中,阴、阳离子的个数比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液的浓度约为0.13mol/L | B. | 反应后溶液中c(Fe3+)=0.1mol/L | ||
| C. | 反应后溶液中c(Fe3+)=c(Fe2+) | D. | 原溶液中c(Br-)=0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(IO3-)、c(HSO3-)逐渐增大 | B. | c(K+)逐渐增大,反应速率加快 | ||
| C. | 溶液的pH减小,IO3-的氧化性增强 | D. | c(H+)增大,反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25g/mol | B. | 27g/mol | C. | 30g/mol | D. | 32g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL 1mol•L-1 NaCl溶液 | B. | 20mL 2mol•L-1 AlCl3溶液 | ||
| C. | 30mL 1mol•L-1 MgCl2溶液 | D. | 100mL 3mol•L-1 NaClO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
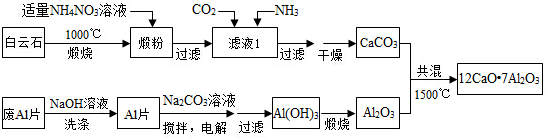
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I的原子半径大于Br,HI比HBr的热稳定性强 | |
| B. | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 | |
| C. | Al2O3和MgO均可与NaOH溶液反应 | |
| D. | SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com