
ЁОЬтФПЁП[ЛЏбЇЁЊбЁао2ЃКЛЏбЇгыММЪѕ]
КЃЫЎеМЕиЧђзмДЂЫЎСПЕФ97.2ЉЁЃШєАбКЃЫЎЕЛЏКЭЛЏЙЄЩњВњНсКЯЦ№РДЃЌМШФмНтОіЕЫЎзЪдДШБЗІЕФЮЪЬтЃЌгжФмГфЗжРћгУКЃбѓзЪдДЁЃ
ЯТЭМЪЧРћгУКЃЫЎзЪдДНјааЛЏЙЄЩњВњЕФВПЗжЙЄвеСїГЬЪОвтЭМЃК

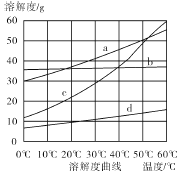
ЃЈ1ЃЉИУЙЄвеСїГЬЪОвтЭМжаАќКЌСЫ ЁЂ ЃЈЬюЛЏбЇЙЄвЕЕФУћГЦЃЉЁЃ
ЃЈ2ЃЉдкСїГЬЂёжаЃЌгћГ§ШЅДжбЮжаКЌгаЕФCa2ЃЋЁЂMg2ЃЋЁЂSO42ЃЋЕШРызгЃЌашНЋДжбЮШмНтКѓЃЌАДЫГађМгШывЉЦЗНјааГСЕэЁЂЙ§ТЫЕШЁЃМгШывЉЦЗКЭВйзїЕФЫГађПЩвдЪЧ ЃЈЬюзжФИЃЉЁЃ
AЃЎNa2CO3ЁЂNaOHЁЂ BaCl2ЁЂЙ§ТЫЁЂбЮЫс
BЃЎNaOHЁЂ BaCl2ЁЂ Na2CO3ЁЂЙ§ТЫЁЂбЮЫс
CЃЎNaOHЁЂ Na2CO3ЁЂ BaCl2ЁЂЙ§ТЫЁЂбЮЫс
DЃЎBaCl2ЁЂNa2CO3ЁЂ NaOHЁЂ Й§ТЫЁЂбЮЫс
ЃЈ3ЃЉСїГЬЂђжаЃЌЭЈЕчПЊЪМКѓЃЌбєМЋЧјВњЩњЕФЦјЬхЪЧ (ЬюЛЏбЇЪН)ЃЌвѕМЋИННќШмвКpHЛс ЃЈЬюЁАдіДѓЁБЁЂЁАМѕаЁЁБЛђЁАВЛБфЁБЃЉЁЃ
ЃЈ4ЃЉСїГЬЂѓжаЃЌЭЈЙ§ЯргІЛЏбЇЗДгІПЩвдЕУЕНNaHCO3ОЇЬхЁЃЯТЭМЮЊNaClЁЂNH4ClЁЂNaHCO3ЁЂNH4HCO3ЕФШмНтЖШЧњЯпЃЌЦфжаФмБэЪОNaHCO3ШмНтЖШЧњЯпЕФЪЧ ЃЌЩњГЩNaHCO3ОЇЬхЕФЛЏбЇЗДгІЗНГЬЪНЪЧ ЁЃ
ЃЈ5ЃЉСїГЬЂєжаЃЌЫљЕУДПМюГЃКЌгаЩйСППЩШмаддгжЪЃЌГЃгУЕФЬсДПЗНЗЈЪЧ ЃЈЬюУћГЦЃЉЃЌЭЈЙ§ИУЗЈЬсДПКѓЕУЕНДПОЛЕФNa2CO3ЁЄ10H2OЃЌNa2CO3ЁЄ10H2OЭбЫЎЕУЕНЮоЫЎЬМЫсФЦЁЃ
вбжЊЃКNa2CO3ЁЄH2O(s)=Na2CO3(s)+H2O(g) ІЄH1=+58.73kJЁЄmol-1
Na2CO3ЁЄ10H2O(s)=Na2CO3ЁЄH2O(s)+9H2O(g) ІЄH2=+473.63 kJЁЄmol-1
АбЭбЫЎЙ§ГЬВњЩњЕФЦјЬЌЫЎЭъШЋвКЛЏЪЭЗХЕФШШФмШЋВПгУгкЩњВњNa2CO3ЫљашЕФФмКФЃЈВЛПМТЧФмСПЫ№ЪЇЃЉЃЌШєЩњВњ1molNa2CO3ашвЊКФФм92.36kJЃЌгЩДЫЕУГіЃКH2O(gЃЉ= H2O(l) ЁїH= ЁЃ
ЁОД№АИЁПЃЈ1ЃЉТШМюЙЄвЕЁЂКюЪЯжЦМю
ЃЈ2ЃЉbd
ЃЈ3ЃЉCl2ЃЌдіДѓЁЃ
ЃЈ4ЃЉd NaCl + CO2 + NH3 + H2O = NaHCO3Ё§+ NH4ClЁЃ
ЃЈ5ЃЉжиНсОЇ(2Зж) - 44.00 kJ/molЁЃ
ЁОНтЮіЁП
ЪдЬтЗжЮіЃКЃЈ1ЃЉИљОнЪОвтЭМПЩжЊИУЙЄвеСїГЬЪОвтЭМжаАќКЌСЫТШМюЙЄвЕЁЂКюЪЯжЦМюЁЃ
ЃЈ2ЃЉCa2ЃЋгУЬМЫсФЦГ§ШЅЃЌMg2ЃЋгУЧтбѕЛЏФЦГ§ШЅЃЌSO42ЃгУТШЛЏБЕГ§ШЅЃЌзюКѓМгШыбЮЫсЫсЛЏЁЃЕЋгЩгкЙ§СПЕФТШЛЏБЕвЊгУЬМЫсФЦРДГ§ЃЌЫљвдЬМЫсФЦБиашЗХдкТШЛЏБЕЕФКѓУцЃЌЖјЧтбѕЛЏФЦПЩвдЫцвтЕїећЃЌД№АИбЁbdЁЃ
ЃЈ3ЃЉСїГЬЂђжаЃЌЭЈЕчПЊЪМКѓЃЌбєМЋЧјТШРызгЗХЕчЃЌВњЩњЕФЦјЬхЪЧCl2ЃЌвѕМЋЩЯЧтРызгЗХЕчЃЌЭЌЪБЦЦЛЕЫЎжаЕФЕчРыЦНКтЃЌШмвКжаЧтбѕИљХЈЖШДѓгкЧтРызгХЈЖШЃЌдђвѕМЋИННќШмвКpHЛсдіДѓЁЃ
ЃЈ4ЃЉСїГЬЂѓжаВњЩњЬМЫсЧтФЦОЇЬхЃЌЫЕУїШмНтЖШзюаЁЃЌдђЦфжаФмБэЪОNaHCO3ШмНтЖШЧњЯпЕФЪЧdЃЌЩњГЩNaHCO3ОЇЬхЕФЛЏбЇЗДгІЗНГЬЪНЪЧNaCl+CO2+NH3+H2OЃНNaHCO3Ё§+NH4ClЁЃ
ЃЈ5ЃЉСїГЬЂєжаЃЌЫљЕУДПМюГЃКЌгаЩйСППЩШмаддгжЪЃЌГЃгУЕФЬсДПЗНЗЈЪЧжиНсОЇЁЃвбжЊЃК
ЂйNa2CO3ЁЄH2O(s)=Na2CO3(s)+H2O(g) ІЄH1=+58.73kJЁЄmol-1
ЂкNa2CO3ЁЄ10H2O(s)=Na2CO3ЁЄH2O(s)+9H2O(g) ІЄH2=+473.63 kJЁЄmol-1
дђИљОнИЧЫЙЖЈТЩПЩжЊЂй+ЂкМДЕУЕНЗДгІЂлNa2CO3ЁЄ10H2O(s)= Na2CO3(s)+10H2O(g)ЕФЗДгІШШІЄHЃН+532.36 kJ/molЁЃШєЩњВњ1molNa2CO3ашвЊКФФм92.36kJЃЌдђЕУЕНЗДгІЂмNa2CO3ЁЄ10H2O(s)ЃНNa2CO3(s)+10H2O(l)ЕФЗДгІШШІЄHЃН+92.36 kJ/molЃЌвђДЫЃЈЂмЃЂлЃЉ/10ПЩЕУЕНH2O(gЃЉ= H2O(l)ЕФЁїH=Ѓ44kJ/molЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЛЅЮЊЭЌЮЛЫиЕФЪЧЃЈ ЃЉ
A. H2D2 B. 14N14C C. 16O17O D. Н№ИеЪЏЪЏФЋ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгаЙиШМЩеЕФЫЕЗЈВЛе§ШЗЕФЪЧЃЈ ЃЉ
AЃЎШМЩевЛЖЈгабѕЦјЕФВЮгы
BЃЎШМЩевЛЖЈЪЧбѕЛЏЛЙдЗДгІ
CЃЎШМЩевЛЖЈгаЗЂЙтЯжЯѓ
DЃЎШМЩевЛЖЈЛсЗХГіШШСП
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПКЃЫЎЪЧОоДѓЕФзЪдДБІПт,ДгКЃЫЎжаЬсШЁЪГбЮКЭфхЕФЙ§ГЬШчЯТЃК
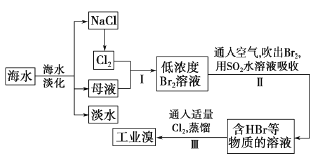
ЃЈ1ЃЉЧыСаОйКЃЫЎЕЛЏЕФСНжжЗНЗЈЃК________ЁЂ_________ЁЃ
ЃЈ2ЃЉВНжшIжаМКЛёЕУBr2ЃЌВНжшIIжагжНЋBr2ЛЙдЮЊBr-ЁЃЦфФПЕФЪЧ_____ЁЃ
ЃЈ3ЃЉВНжшIIгУSO2ЫЎШмвКЮќЪеBr2ЃЌЮќЪеТЪПЩДя95% ЁЃгаЙиЗДгІЕФРызгЗНГЬЪНЮЊ_________ЁЃ
ЃЈ4ЃЉФГЛЏбЇбаОПадбЇЯАаЁзщЮЊСЫСЫНтДгЙЄвЕфхжаЬсДПфхЕФЗНЗЈЁЃВщдФСЫгаЙизЪСЯжЊЃКBr2ЕФЗаЕуЮЊ59 Ёц.ЮЂШмгкЫЎЃЌгаЖОВЂгаЧПИЏЪДадЁЃЫћУЧВЮЙлЩњВњЙ§ГЬКѓЃЎЛСЫШчЯТзАжУМђЭМЃК
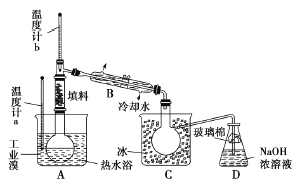
ЧыФуВЮгыЗжЮіЬжТлЃК
ЂйЭМжавЧЦїBЕФУћГЦЪЧ_______ЁЃ
Ђк ећЬзЪЕбщзАУѓжавЧЦїСЌНгОљВЛФмгУЯ№НКШћКЭЯ№НКЙмЁЃЦфдвђЪЧ_______ЁЃ
Ђл ЪЕбщзАжУЦјУмадСМКУЃЌвЊДяЕНЬсДПфхЕФФПЕФЃЌВйзїжаШчКЮПижЦЙиМќЬѕМўЃП_______ЁЃ
Ђм CжавКЬхбеЩЋЮЊ_______ЁЃЮЊГ§ШЅИУВњЮяжаШдВаСєЕФЩйСПCl2ЃЌПЩЯђЦфжаМгШыNaBr,ШмвКЃЌГфЗжЗДгІКѓЃЎдйНјааЕФЗжРыВйзїЪЧ_______ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТЭМЪЧвдZnКЭCuЮЊЕчМЋЃЌЯЁH2SO4ЮЊЕчНтжЪШмвКаЮГЩЕФдЕчГиЃЌФГЪЕбщаЫШЄаЁзщзіЭъЪЕбщКѓЃЌдкЖСЪщПЈЦЌЩЯМЧТМШчЯТЃК
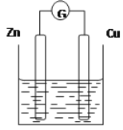
DateЃК2016.03.06 ЪЕбщКѓЕФМЧТМЃК ЂйZnЮЊбєМЋЃЌCuЮЊвѕМЋ ЂкH+ЯђИКМЋвЦЖЏ ЂлЕчзгСїЖЏЗНЯђZnЁњCu ЂмCuМЋгаH2ВњЩњ ЂнШєга1molЕчзгСїЙ§ЕМЯпЃЌдђВњЩњH2ЮЊ0.5mol Ђое§МЋЕФЕчМЋЗДгІЪНЃКZnЈD2eЈDЃНZn2ЃЋ |
ЃЈ1ЃЉдкПЈЦЌЩЯЃЌа№ЪіКЯРэЕФЪЧ ЃЈЬюађКХЃЉЁЃ
ЃЈ2ЃЉдкЪЕбщжаЃЌМзЭЌбЇЗЂЯжВЛНідкЭЦЌЩЯгаЦјХнВњЩњЃЌЖјЧвдкаПЦЌЩЯвВВњЩњСЫЦјЬхЃЌЗжЮідвђПЩФмЪЧ ЁЃ
ЃЈ3ЃЉШчЙћАбаПЦЌЛЛГЩЪЏФЋЃЌЗЂЯжЕчСїМЦжИеыМИКѕВЛФмЦЋзЊЃЌдвђЪЧ ЁЃ
ЃЈ4ЃЉШчЙћАбСђЫсЛЛГЩСђЫсЭШмвКЃЌВТВт ЃЈЬюЁАаПМЋЁБЛђЁАЭМЋЁБЃЉБфДжЃЌдвђЪЧ ЃЈгУЕчМЋЗНГЬЪНБэЪОЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛЏбЇдЊЫиМвзхгжЬэаТГЩдБЃЌ113КХдЊЫиUutКЭ115КХдЊЫиUupЁЃвбжЊ113КХдЊЫиЕФвЛжжКЫЫиЮЊ![]() UutЃЌЯТСаЫЕЗЈжае§ШЗЕФЪЧ
UutЃЌЯТСаЫЕЗЈжае§ШЗЕФЪЧ
A. 113КХдЊЫиЕФЯрЖддзгжЪСПЮЊ278
B. 115КХдЊЫиПЩЯд+5Мл
C. ![]() UutЕФжазгЪ§гыЕчзгЪ§жЎВюЮЊ165
UutЕФжазгЪ§гыЕчзгЪ§жЎВюЮЊ165
D. СНжждЊЫиОљЮЛгкжмЦкБэЕкАЫжмЦк
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖўТШЛЏЖўСђЃЈS2Cl2ЃЉЪЧЙуЗКгУгкЯ№НКЙЄвЕЕФСђЛЏМСЃЌЦфЗжзгНсЙЙШчЯТЭМЫљЪОЁЃГЃЮТЯТЃЌS2Cl2гіЫЎвзгыЫЎЗЂЩњЗДгІЃЌВЂВњЩњФмЪЙЦЗКьЭЪЩЋЕФЦјЬхЃЌЯТСаЫЕЗЈжаДэЮѓЕФЪЧ
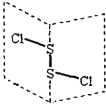
AЃЎS2Cl2ЕФНсЙЙЪНЮЊ ClЁЊSЁЊSЁЊCl
BЃЎ S2Cl2гыЫЎЗДгІЪБжЛгаSЁЊClЖЯСб
CЃЎS2Br2КЌгаМЋадМќКЭЗЧМЋадМќ
DЃЎS2Cl2гыH2OЗДгІЕФЛЏбЇЗНГЬЪНПЩФмЮЊЃК2S2Cl2+2H2O=SO2Ёќ+3SЁ§+4HCl
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЯТЭМЃЌЙиБеЛюШћKЃЌЯђAжаГфШы1 molXЁЂ1 molYЃЌЯђBжаГфШы2 molXЁЂ2 molYЃЌДЫЪБAЁЂBЕФШнЛ§ЖМЪЧa LЁЃдкЯрЭЌЮТЖШКЭДпЛЏМСДцдкЕФЬѕМўЯТЃЌЪЙСНШнЦїжаИїздЗЂЩњЯТЪіЗДгІЃКX(g)+Y(g) ![]() 2Z(g)+W(g)ЃЛЁїH<0ЁЃAБЃГжКубЙЃЌBБЃГжКуШнЃЌДяЦНКтЪБЃЌAЕФЬхЛ§ЮЊ1.4a LЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
2Z(g)+W(g)ЃЛЁїH<0ЁЃAБЃГжКубЙЃЌBБЃГжКуШнЃЌДяЦНКтЪБЃЌAЕФЬхЛ§ЮЊ1.4a LЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
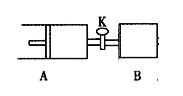
AЃЎЗДгІЫйТЪЃКv(B)>v(A)
BЃЎBШнЦїжаXЕФзЊЛЏТЪЮЊ80%
CЃЎЦНКтЪБЕФбЙЧПЃК2p(A)=p(B)
DЃЎЦНКтЪБYЕФЬхЛ§ЗжЪ§ЃКA>B
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛЏбЇдкЩњВњКЭШеГЃЩњЛюжагазХживЊЕФгІгУЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ( )
AЃЎУїЗЏЫЎНтаЮГЩЕФAl(OH)3НКЬхФмЮќИНЫЎжааќИЁЮяЃЌПЩгУгкЫЎЕФОЛЛЏ
BЃЎдкКЃТжЭтПЧЩЯЃЎЯтШыаППщЃЌПЩМѕЛКДЌЬхЕФИЏЪДЫйТЪ
CЃЎMgOЕФШлЕуКмИпЃЌПЩгУгкжЦЗзїФЭИпЮТВФСЯ
DЃЎЕчНтMgCl2БЅКЭШмвКЃЌПЩжЦЕУН№ЪєУО
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com