
| A. | 利用空气吹出SO2吸收法从海水中提溴时,直接将海水氯化,然后再进行吹出、吸收可得到溴产品 | |
| B. | 从海水中提取的重水可作原子能反应堆的中子减速剂和传热介质 | |
| C. | 盐田法制盐时,所用的盐田一般分成贮水池、蒸发池、结晶池三部分 | |
| D. | 利用电渗析法,冷冻法制盐,同时也可以得到淡水 |
分析 A,海水要先浓缩晒盐,得到卤水中加入氯气氯化得到溴单质被空气吹出后用二氧化硫吸收富集,再加入酸发生氧化还原反应得到溴单质;
B.由重氢氧化而成的水叫重水(D2O),D2O可做为原子能反应堆的中子减速剂和传热介质.两个氘核在高温高压下可融合成氦核,同时释放大量的能量,这个过程叫热核聚变.海水中含有2.0×1014t的重水,可供人类使用上百亿年;
C.根据溶解度受影响的大小,选择结晶的操作方法--蒸发结晶或降温结晶法;溶解度受温度影响不大的物质结晶时一般采取蒸发结晶的方法;海水中含有大量的氯化钠,工业上采取晒海水使水分蒸发,最后制得食盐的方法,根据蒸发结晶步骤分析盐田组成;
D.根据淡化海水的常用方法分析即可,淡化海水,应将水与海水中的盐进行分离,常见的方法有:蒸馏法、膜法、冷冻法、离子交换法等;
解答 解:A.海水要先浓缩晒盐,得到卤水中加入氯气氯化得到溴单质被空气吹出后用二氧化硫吸收富集,不能直接氯化,故A错误;
B.D2O可做为原子能反应堆的中子减速剂和传热介质.两个氘核在高温高压下可融合成氦核,同时释放大量的能量,这个过程叫热核聚变,从海水中提取的重水可作原子能反应堆的中子减速剂和传热介质,故B正确;
C.“夏天晒盐”是因为食盐的溶解度受温度变化的影响不大,夏天气温高,水分蒸发快,食盐易结晶析出;海水制盐的过程主要是海水蒸发后出现结晶盐,工业上采取晒海水使水分蒸发,最后制得食盐,所以盐田一般分为储水池、蒸发池、结晶池三部分,故C正确;
D.目前淡化海水的方法有多种,如:蒸馏法、结晶法、淡化膜法、多级闪急蒸馏法、冷冻法、离子交换法、反渗透法等,结合能源消耗等问题冷冻法、离子交换法、反渗透法消耗能量少,故D正确;
故选A.
点评 本题考查了海水资源的利用主要是海水提溴、海水晒盐、海水淡化、海水提取的重水等知识点,注意知识的积累,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 220mL | B. | 240mL | C. | 260mL | D. | 280mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠离子与氯离子F之间存在互相吸引又互相排斥的相互作用 | |
| B. | 不存在氯化钠的分子 | |
| C. | 每个钠离子同时吸引6个氯离子,每个氯离子同时吸引6个钠离子 | |
| D. | 在一个钠离子周围距离相等,并且最接近的钠离子共有6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
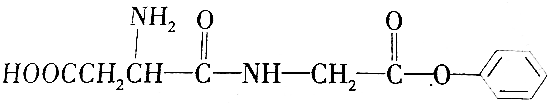
| A. | A的分子式为C12H15O5N2 | |
| B. | 通常用酒精梢灭该细菌,其原理是酒精使细菌中的蛋白质水解而失去生理活性 | |
| C. | A的水解产物中一定含有醇类 | |
| D. | 1 mol A最多可以与1 L 4mol•L-1的Na0H溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质与氨基酸一样也是两性分子,既能与酸反应,又能与碱反应 | |
| B. | 豆浆中富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 | |
| C. | 浓Na2SO4溶液能使蛋白质溶液中的蛋白质析出,加水后析出的蛋白质又溶解,但已失去生理活性 | |
| D. | 核酸是由C、H、0、P、N等元素组成的小分子有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
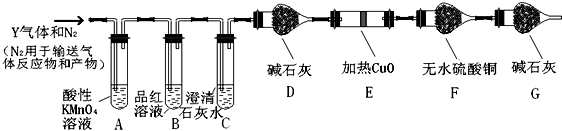 (2)写出产生CO2的化学方程式C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O.
(2)写出产生CO2的化学方程式C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O.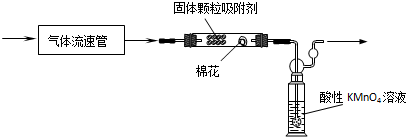
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
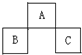 A、B、C均为周期表中的短周期的元素,它们在周期表的位置如下图.已知B、C两元素在周期表中族数之和是A元素族数的2倍;B、C元素的原子序数之和是A 元素的原子序数的4倍,则A、B、C所在的一组是 ( )
A、B、C均为周期表中的短周期的元素,它们在周期表的位置如下图.已知B、C两元素在周期表中族数之和是A元素族数的2倍;B、C元素的原子序数之和是A 元素的原子序数的4倍,则A、B、C所在的一组是 ( )| A. | Be、Na、Al | B. | P、O、Cl | C. | O、P、Cl | D. | C、Al、P |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
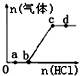 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应的溶液中:Na+、Ca2+、SO42-、NO3- | |
| B. | b点对应的溶液中:K+、Na+、OH-、Cl- | |
| C. | c点对应的溶液中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应的溶液中:Cl-、NO3-、Fe2+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4和C4H8 | B. | CH4和C3H6 | C. | C2H6 和C3H6 | D. | C2H6 和C4H8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com