
 ��1.0L�ܱ������з���0.10molA��g������һ���¶Ƚ������·�Ӧ��
��1.0L�ܱ������з���0.10molA��g������һ���¶Ƚ������·�Ӧ��| ʱ��t/h | 0 | 1 | 2 | 4 | 8 | 16 |
| ��ѹǿp/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 8.54 |
| c��A��/��mol•L-1�� | 0.10 | 0.086 | 0.071 | 0.051 | a | a |
���� ��1��G=��H-T��S����GΪ�����ܱ仯����HΪ�ʱ䣬TΪ����ѧ�¶ȣ���S�ر䣬����G��0ʱ��Ӧ���Է����У���G��0ʱ��Ӧ�����Է����У��ݴ˷����жϣ�
��2����ͬ������ѹǿ֮�ȵ������ʵ���֮�ȣ���Ӧǰ�����ʵ�����������ڷ�Ӧ��A�����ʵ��������ת���ʸ������õ���
��3����ѧƽ�ⳣ��Ϊ������Ũ��ϵ�����ݵij˻��뷴Ӧ��Ũ��ϵ�����ݳ˻��ı�ֵ��Kp�ı���ʽ�ǽ�ƽ���ѹ����ƽ��Ũ�ȣ�ij���ʵ�ƽ���ѹ=��ѹ�������ʵ����ʵ���������
��4��ͬ��ͬѹ�£�ѹǿ֮�ȵ������ʵ���֮�ȣ�����A��g��?B��g��+C��g������Ӧǰ����������ʵ���Ϊ��Ӧ��A�����ʵ�������ϱ���ѹǿ�����ʵ����Ĺ�ϵ���㣻
��5�������¶ȣ������淴Ӧ���ʾ��ӿ죬����ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ�������Ӧ����ƽ�⣬ƽ��ʱA�����ʵ���Ũ�ȼ�С���淴Ӧ����ƽ�⣬ƽ��ʱB��C�����ʵ���Ũ������
��� �⣺��1����Ӧ�Է�������Ҫ���㣬��H-T��S��0���������������֪��A��g��?B��g��+C��g����H=+285.1kJ•mol-1������ӦΪ�������������ķ�Ӧ����S��0������Ӧ���ȣ���H=+285.1kJ•mol-1��0�����Է�Ӧһ�����ڸ��������²����Է����У�
�ʴ�Ϊ�����£�
��2����Ӧǰ���������ʵ������������ڷ�Ӧ��A��������������ѹǿp����ʼѹǿp0���㷴Ӧ��A��ת���ʦ���A���ı���ʽ=$\frac{P-{P}_{0}}{{P}_{0}}$��100%=��$\frac{P}{{P}_{0}}$-1����100%��
ƽ��ʱA��ת���ʦ���A��=��$\frac{8.54}{4.91}$-1����100%=73.9%��
�ʴ�Ϊ����$\frac{P}{{P}_{0}}$-1����100%��73.9��
��3����Ӧ��A��ת���ʦ���A����A��g��?B��g��+C��g����
��ʼ��mol/L����0.1 0 0
�仯��mol/L����0.1����A�� 0.1����A�� 0.1����A��
���ˣ�mol/L����0.1-0.1����A�� 0.1����A�� 0.1����A��
��ѧƽ�ⳣ��Ϊ������Ũ��ϵ�����ݵij˻��뷴Ӧ��Ũ��ϵ�����ݳ˻��ı�ֵ�����ʵ�ƽ���ѹ=��ѹ�������ʵ����ʵ�������������ƽ�ⳣ��KP=$\frac{\frac{0.1����A��}{[0.1+0.1����A��]}p��\frac{0.1����A��}{[0.1+0.1����A��]}p}{\frac{0.1+0.1����A��}{[0.1+0.1����A��]}P}$=$\frac{{��}^{2}��A��}{[1+����A��]��[1-����A��]}P$��
�ʴ�Ϊ��$\frac{{��}^{2}��A��}{[1+����A��]��[1-����A��]}P$��
��4����ѹǿ��P��ʾ����ʼѹǿ��P0��ʾ��ͬ��ͬѹ�£�ѹǿ֮�ȵ������ʵ���֮�ȣ�$\frac{{P}_{0}}{0.1}=\frac{P}{{n}_{��}}$��n��=0.1��$\frac{P}{{P}_{0}}$��A��g��?B��g��+C��g������Ӧ�����У�n��A�����ģ�n��=��P-P0����P��A���ʵ���n��A��=0.1-n��A������=0.1-n����$\frac{P-{P}_{0}}{P}$=0.1-0.1��$\frac{P}{{P}_{0}}$��$\frac{P-{P}_{0}}{P}$=0.1����2-$\frac{P}{{P}_{0}}$��mol����ѹǿP=8.54��100kPaʱ��Ӧ�ﵽƽ��״̬��P0=4.91��100KPa��A��ת���ʦ���A���ı���ʽ=$\frac{P-{P}_{0}}{{P}_{0}}$��100%=$\frac{8.54-4.91}{4.91}$��100%��c��A��=$\frac{��0.1-0.1��\frac{8.54-4.91}{4.91}��mol}{1L}$��0.026mol/L��
�ʴ�Ϊ��0.1��$\frac{P}{{P}_{0}}$��0.1����2-$\frac{P}{{P}_{0}}$����c��A��=0.026mol/L��
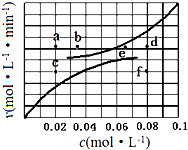
��5������A��g��?B��g��+C��g������H=+285.1kJ•mol-1��Ӧ����ƽ��ʱ�������¶ȣ������淴Ӧ���ʾ��ӿ죬����ų�C�㣬����ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ������ƽ�������ƶ����ٴ�ƽ��ʱA�����ʵ���Ũ�ȼ�С������ų�b�㣬��ѡa�㣻����A��g��?B��g��+C��g������Ӧ����ƽ��ʱ�������¶ȣ������淴Ӧ���ʾ��ӿ죬�����¶ȣ�ƽ�������ȷ�Ӧ�����ƶ������ƽ�������ƶ����ٴ�ƽ��ʱB��C�����ʵ���Ũ������ѡd�㣬
�ʴ�Ϊ��a��d��
���� ���⿼��ѹǿ��ϵ�����ʵ����ļ���Ӧ�ã���ѧƽ����㷽����ͼ�����ݴ��������ķ����жϣ����ؿ���ѧ����ѧ������������������������ע���������Ϊѹǿ��ϵ�����ʵ����Ĺ�ϵ����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2O��H2 | B�� | Zn��Zn2+ | C�� | Fe3+��Fe2+ | D�� | CuO��CuCl2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| a | b | c | |
| �� | �������ɫ���� | ʪ�����ɫ���� | ʪ�����ɫ���� |
| �� | ��ʯ�� | Ũ���� | ��ˮ�Ȼ��� |
| �� | ʪ�����ɫ���� | �������ɫ���� | �������ɫ���� |
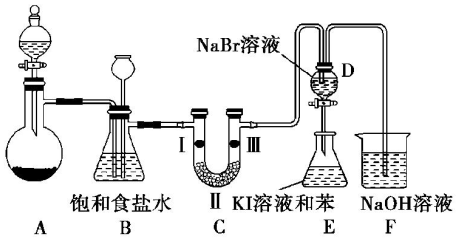
 ���������� D�е�������Һ����E�У���E���۲쵽E����Һ��Ϊ���㣬�ϲ㣨���㣩Ϊ�Ϻ�ɫ���������ܣ� ��ܡ����ܡ���˵��Br2�������Դ���I2��
���������� D�е�������Һ����E�У���E���۲쵽E����Һ��Ϊ���㣬�ϲ㣨���㣩Ϊ�Ϻ�ɫ���������ܣ� ��ܡ����ܡ���˵��Br2�������Դ���I2���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 NO������⻯ѧ�������ƻ������㣮����NO�ж��ַ��������������ش��������⣺
NO������⻯ѧ�������ƻ������㣮����NO�ж��ַ��������������ش��������⣺| ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | �� |
| c��NO��/mol•L-1 | 1.00��10-3 | 4.00��10-4 | 1.70��10-4 | 1.00��10-4 | 1.00��10-4 | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �ݱ�����һ�������� Fe2O3�ɱ����黹ԭΪ���������Ľ��������䷴ӦΪ��Fe2O3��s��+3CH4��g��?2Fe��s��+3CO��g��+6H2��g��
�ݱ�����һ�������� Fe2O3�ɱ����黹ԭΪ���������Ľ��������䷴ӦΪ��Fe2O3��s��+3CH4��g��?2Fe��s��+3CO��g��+6H2��g���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ������� | �¶�/�� | ��ʼ���ʵ���/mol | ƽ�����ʵ���/mol | ||
| H2 | SO2 | H2 | SO2 | ||
| ������ | 300 | 0.3 | 0.1 | 0.02 | |
| ������ | 300 | 0.6 | 0.2 | ||
| ������ | 240 | 0.3 | 0.1 | 0.01 | |
| A�� | �÷�Ӧ����ӦΪ���ȷ�Ӧ | |
| B�� | ������ﵽƽ���ʱ�������I�� | |
| C�� | 240��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ1.08��104 | |
| D�� | ������ﵽƽ��ʱSO2��ת���ʱ�����IС |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  | B�� |  | ||
| C�� |  | D�� |  |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com