
| A. | 气象环境报告中的“PM2.5”是一种新分子的描述 | |
| B. | 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量、 | |
| C. | “玉兔号”月球车太阳能电池帆板的材料是二氧化硅 | |
| D. | 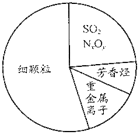 如图为雾霾的主要成分示意图,SO2和NxOy都属于酸性氧化物 |
分析 A.PM2.5属于颗粒污染物,不是新分子;
B.采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,减少了空气污染物;
C.制作太阳能电池的原料是晶体硅,而不是石英;
D.NxOy组成未知,不一定是酸性氧化物.
解答 解:A.PM2.5颗粒直径小于2.5μm,不是新分子,为粒子聚合体,故A错误;
B.通过“静电除尘”、“燃煤固硫”和“汽车尾气催化净化”提高空气质量,可减少粉尘污染、酸雨等,故B正确;
C.“玉兔号”月球车太阳能电池帆板的材料为晶体硅,二氧化硅是制作光导纤维的原料,故C错误;
D.二氧化硫为酸性氧化物,但NxOy组成未知,不一定是酸性氧化物,故D错误.
故选B.
点评 本题涉及的素材与当今社会中的焦点热点问题联系紧密,有利于培养学生良好的科学素养,提高学习的积极性,学会用化学知识解答现实问题是学习化学的重要功能,此题难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 甲、乙、丙三种物质均含有铝元素,在溶液中的转化关系如图所示.下列说法正确的是( )
甲、乙、丙三种物质均含有铝元素,在溶液中的转化关系如图所示.下列说法正确的是( )| A. | 若甲是Al,丙是Al(NO3)3,则乙一定是NaAlO2 | |
| B. | 若甲是Al2O3,丙是NaAlO2,则乙一定是Al(NO3)3 | |
| C. | 若甲是Al(NO3)3,丙是NaAlO2,则乙一定是Al(OH)3 | |
| D. | 若甲是Al(OH)3,丙是Al(NO3)3,则乙一定是NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
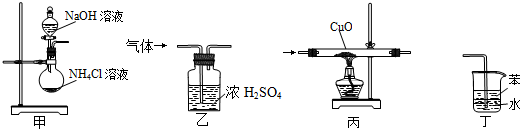
| A. | 用装置甲制取氨气 | B. | 用装置乙除去氨气中的水蒸气 | ||
| C. | 用装置丙验证氨气具有还原性 | D. | 用装置丁吸收氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加碘食盐能使淀粉溶液变蓝 | |
| B. | PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成混合物属于胶体 | |
| C. | 装饰装修材料中的甲醛、芳香烃及放射性物质都会造成室内污染 | |
| D. | 煤经过气化和液化两种物理变化,可变为清洁能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁生锈,负极反应式为:Fe-3e-=Fe3+ | |
| B. | 用石墨做电极电解硫酸铜溶液,有Cu和O2析出:2Cu2++4OH-$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2O | |
| C. | Na2CO3溶液滴加酚酞,溶液变红:CO32-+2H2O?H2CO3+2OH- | |
| D. | 酸性高锰酸钾溶液中加入草酸钠,溶液褪色:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
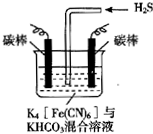 [Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )
[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )| A. | 电解时阳极反应式为[Fe(CN)6]4--e-═[Fe(CN)6]3- | |
| B. | 电解时阴极反应式为2HCO3-+2 e-═H2↑+2CO32- | |
| C. | 当电解过程中有22.4L标准状况下的H2生成时,溶液中有32gS析出(溶解忽略不计) | |
| D. | 整个过程中需要不断补充K4[Fe(CN)6]与KHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液中:K+、Fe3+、NO3-、Cl- | |
| B. | 酸性溶液中:HClO、K+、SO42-、I- | |
| C. | 强碱性溶液中:Ca2+、K+、HCO3-、NO3- | |
| D. | 碱性溶液中:Na+、SO32-、NO3-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微置的锎、硼、镓、硒等.
太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微置的锎、硼、镓、硒等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
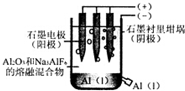
| A. | 电解过程中每转移12 mol电子,会产生2 molO2 | |
| B. | 加入助熔剂冰晶石(Na3AIF6)可降低电解的温度 | |
| C. | 电解过程中阳极反应式4A13++12e-→4Al | |
| D. | 若用该装置电解氯化铝溶液也能得到金属铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com