
| A. | 在Na2B、NaHB两溶液中,离子种类不相同 | |
| B. | 二元酸H2B为强酸 | |
| C. | 在NaHB溶液中一定有:c(Na+)+c(H+)=c(HB-)+c(OH-)+2c(B2-) | |
| D. | 在Na2B溶液中一定有:c(Na+)>c(B2-)>c(H+)>c(OH-) |
分析 已知0.1mol•L-1的二元酸H2B溶液的pH=4,说明溶液为弱酸;
A.在Na2B、NaHB两溶液中,B2-离子水解,HB-存在电离和水解;
B.根据溶液中pH判断;
C.依据溶液中电荷守恒计算判断;
D.B2-离子分步水解,溶液呈碱性
解答 解:A.在Na2B、NaHB两溶液中,分析B2-离子水解,HB-存在电离和水解;离子种类相同,故A错误;
B.已知0.1mol•L-1的二元酸H2B溶液的pH=4,说明H2B在溶液中部分电离,所以H2B为弱酸,故B错误;
C.在NaHB溶液中一定有电荷守恒,结合溶液中离子种类写出电荷守恒:c(Na+)+c(H+)=c(HB-)+c(OH-)+2c(B2-),故C正确;
D.在Na2B溶液中,B2-离子分步水解,溶液呈碱性;一定有:c(Na+)>c(B2-)>c(OH-)>c(H+),故D错误;
故选C.
点评 本题考查了电解质溶液中离子浓度大小比较方法,溶液中电荷守恒的分析判断,溶液中离子的特征性质和水解、电离,是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 向稀硫酸中加硫酸钾溶液 | B. | 将锌粒制成薄锌片 | ||
| C. | 向稀硫酸中加碳酸钠固体 | D. | 向稀硫酸中加硝酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合液中由水电离出的c(H+)=1×10-8mol/L | |
| B. | c(A-)+c(HA)=2c(Na+)=0.4mol/L | |
| C. | HA溶液中$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$与混合液中$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$相等 | |
| D. | c(A-)-c(HA)=2c(OH-)-2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
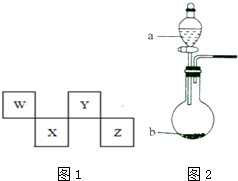 W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.
W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.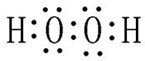 ,Z在周期表中的位置第三周期ⅦA族.
,Z在周期表中的位置第三周期ⅦA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸雨就是pH<7的雨水,主要是由大气中的SO2、NO2等造成的 | |
| B. | 饱和氯水既有酸性又有漂白性,加入NaHCO₃后漂白性减弱 | |
| C. | 烧融烧碱应选用的器皿是铁坩埚而不是石英坩埚、普通玻璃坩埚或陶瓷坩埚 | |
| D. | 用纯碱制玻璃、用铁矿石炼铁、用氨制碳酸铵都会产生温室气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
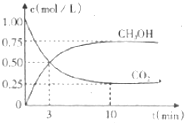 固定和利用C02.能存效地利用资源,并减少空气中的温室气体.工业上正在研究利用C02来生产甲醇燃料的方法,该方法的化学方程式是C02 (g)+3H2 (g)?CH30H (g)+H2O(g)△H=-49.0kJ/mol,在体积为1L的密闭容器中,充人1molCO2和4molH2,一定条件下发生反应:测得C02和CH30H(g)的浓度随时间变化如图所示.下列说法正确的是
固定和利用C02.能存效地利用资源,并减少空气中的温室气体.工业上正在研究利用C02来生产甲醇燃料的方法,该方法的化学方程式是C02 (g)+3H2 (g)?CH30H (g)+H2O(g)△H=-49.0kJ/mol,在体积为1L的密闭容器中,充人1molCO2和4molH2,一定条件下发生反应:测得C02和CH30H(g)的浓度随时间变化如图所示.下列说法正确的是| A. | 该反应在高温条件下能向发进行 | |
| B. | 充人 He(g).能使 $\frac{n(C{H}_{3}OH)}{n(C{0}_{2})}$增大 | |
| C. | 再充入1molCO2和4molH2,能使$\frac{n(C{H}_{2}OH)}{n(C{O}_{2})}$增大 | |
| D. | 容器内气体密度不再改变说明该飞应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
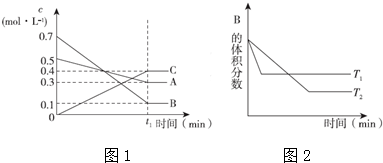
| A. | 该平衡体系的化学反应方程式为:3A(g)+B(g)═4 C(g) | |
| B. | 在t1时间内用B表示该反应的平均速率为0.6/t1mol•L-1•min-1 | |
| C. | 其他条件不变,升高温度,正反应速率减小、逆反应速率增大,A的转化率减小 | |
| D. | 维持温度和容器体积不变,往平衡体系中充惰性气体,C的百分含量增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com