
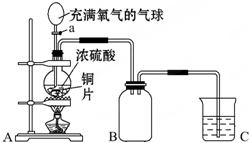
 小明同学设计了如图所示装置来探究铜跟浓硫酸的反应.
小明同学设计了如图所示装置来探究铜跟浓硫酸的反应.分析 (1)依据装置图和实验步骤分析,装置A中在关闭a后加热烧瓶反应,铜和浓硫酸反应生成硫酸铜、二氧化硫和水,再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢消失是铜和氧气反应生成氧化铜,氧化铜和硫酸反应生成硫酸铜和水;
(2)B装置是收集装置,二氧化硫气体比空气重,需要用向上排气法收集;
(3)二氧化硫气体的氧化性是硫元素化合价降低,表现还原性是硫元素化合价升高分析;
(4)二氧化硫是污染性的气体,不能排放到空气中,需要用氢氧化钠溶液吸收.
解答 解:(1)装置图和实验步骤可知,先关闭活塞a,加热至烧杯中不再有气泡产生时,停止反应,此时烧瓶中铜片仍有剩余,反应方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢消失,发生的反应为:2Cu+2H2SO4+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O(或2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+H2SO4═CuSO4+2H2O),
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;2Cu+2H2SO4+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O;
(2)B装置是收集装置,二氧化硫气体比空气重,需要用向上排气法收集,导气管长进短出,改进后的装置图为: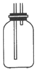 ,
,
故答案为:B;
(3)二氧化硫气体的氧化性是硫元素化合价降低,表现还原性是硫元素化合价升高的反应,二氧化硫表现还原性的反应如:2SO2+O2$\frac{\underline{\;催化剂\;}}{△}$2SO3,
故答案为:2SO2+O2$\frac{\underline{\;催化剂\;}}{△}$2SO3;
(4)二氧化硫是污染性的气体,不能排放到空气中,需要用氢氧化钠溶液吸收,装置C的作用是吸收尾气中的SO2,防止污染空气,
故答案为:吸收尾气中的SO2,防止污染空气.
点评 本题考查了浓硫酸的性质及产物性质的验证,题目难度中等,注意尾气吸收装置和收集装置的分析判断,明确发生反应原理为解答关键,试题培养了学生的化学实验能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的平衡常数表达式:K=$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$ | |
| B. | 若容器内气体的压强保持不变,说明该反应已达到平衡状态 | |
| C. | 若Fe3O4足量,改变起始充入H2的浓度,达平衡时H2的转化率不变 | |
| D. | 经2min后,H2浓度下降了0.1mol.L-1则反应速度为v(H2O)=0.05mol.L-1.min-1. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol•L-1) | 0.100 | 0.070 | 0.050 | 0.040 | 0.040 | 0.040 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在元素周期表金属与非金属分界线附近能找到制半导体材料的元素 | |
| B. | 离子键、共价键、氢键都是化学键 | |
| C. | 元素周期律是元素原子核外电子排布周期性变化的必然结果 | |
| D. | 元素周期表揭示了化学元素间的内在联系,是化学发展史上的重要里程碑 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com