


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

浓度/mol?L-1 时间/min |
NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
科目:高中化学 来源: 题型:
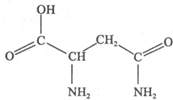 天冬酰胺(结构如图)在芦笋中含量丰富,具有提高身体免疫力的功效.
天冬酰胺(结构如图)在芦笋中含量丰富,具有提高身体免疫力的功效.| 化学式 | 键长/nm | 键角 | 沸点/℃ |
| H2S | 1.34 | 92.3° | -60.75 |
| H2Se | 1.47 | 91.0° | -41.50 |
| 编号 | I5/kJ?mol-1 | I6/kJ?mol-1 | I7/kJ?mol-1 | I8/kJ?mol-1 |
| A | 6990 | 9220 | 11500 | 18770 |
| B | 6702 | 8745 | 15455 | 17820 |
| C | 5257 | 6641 | 12125 | 13860 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | ||
| 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一样多 | B、Na最多 |
| C、Mg最多 | D、Al最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 配制100mL 0.1mol?L-1的硫酸 |
B、 吸收氨气并防止倒吸 |
C、 制取少量乙烯气体 |
D、 验证溴乙烷发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是溶液中存在如下平衡:CH3COO-+H2O?CH3COOH+OH-,使得溶液中的c(OH-)>c(H+) |
| B、某温度下,容积一定的密闭容器中进行可逆反应,X(g)+Y(g)?2Z(g)+W(s)△H>0平衡后,升高温度,c(Z)增大 |
| C、常温下,在醋酸溶液中加入少量的CH3COONa固体,会使其电离平衡正向移动 |
| D、在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,平衡向溶解的方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com