
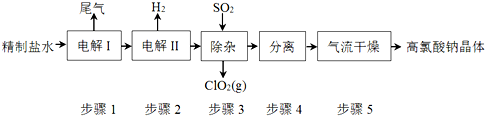
分析 由原料氯化钠到高氯酸钠晶体,氯的化合价升高,而整个流程中未加强氧化剂,所以通过电解实现了氯的不同价态的转化(电解过程即为氧化还原反应),将制得的盐水一次电解产生氯酸钠,得到的氯酸钠溶液进行再一次电解,生成高氯酸钠,然后通入二氧化硫除去其中的氯酸钠,最后进行分离提纯得到高氯酸钠晶体;
(1)①NaOH是离子型化合物,另外氢和氧之间存在共价键;
②SO42-通常是利用稀盐酸和BaCl2溶液来检验;
③Ba2++CO32-=BaCO3↓,向粗盐配制的溶液里滴加Na2CO3溶液可以生成BaCO3沉淀;
(2)Br-的还原性比Cl-强,惰性电极电解食盐水时还原性强的更容易被氧化;
(3)可利用原子守恒计算制取得到的高氯酸钠晶体的质量;
(4)步骤3利用SO2可除去少量的NaClO3,得到ClO2和Na2SO4,依据电子守恒、电荷守恒及原子守恒配平得到离子反应方程式;
(5)高氯酸钠晶体受热易分解,步骤5气流干燥时,应控制温度不易太高.
解答 解:由原料氯化钠到高氯酸钠晶体,氯的化合价升高,而整个流程中未加强氧化剂,所以通过电解实现了氯的不同价态的转化(电解过程即为氧化还原反应),将制得的盐水一次电解产生氯酸钠,得到的氯酸钠溶液进行再一次电解,生成高氯酸钠,然后通入二氧化硫除去其中的氯酸钠,最后进行分离提纯得到高氯酸钠晶体;
(1)①NaOH晶体中含有离子键和共价键,故答案为:离子键和共价键;
②为检验溶液里的SO42-可先用稀盐酸酸化,再滴加BaCl2溶液有白色沉淀生成,故答案为:先用稀盐酸酸化,再滴加BaCl2溶液有白色沉淀生成;
③滴加Na2CO3溶液可以除去溶液里的Ba2+,生成BaCO3沉淀,故答案为:除去溶液里的Ba2+;
(2)电解池中阳极左右还原性强的Br-会先被氧化,则电解前先除去溶液中的Br-,故答案为:避免Br-会先被氧化,而耗能;
(3)106La mol/LNaCl的食盐水中NaCl的物质的量为a mol/L×106L=a×106mol,依据原子守恒理论上得到的高氯酸钠晶体质量为:a×106mol×122.5g/mol=1.225a×108g=122.5a吨,故答案为:122.5a;
(4)步骤3利用SO2可除去少量的NaClO3发生反应的离子反应方程式为:SO2+2ClO3-=SO42-+2ClO2↑;答案为:SO2+2ClO3-=SO42-+2ClO2↑;
(5)因为高氯酸钠在较高温度下容易分解或失去结晶水,温度过低,干燥不充分;所以“气流干燥”时温度应控制在80~100℃之间,故答案为:温度过高,高氯酸钠晶体失去结晶水或高氯酸钠分解,温度过低,干燥不充分.
点评 本题以电解精制食盐水制备高氯酸钠晶体为载体,考查物质的制备实验的工业设计,题目难度中等,本题注意把握物质的性质,为解答该题的关键.


科目:高中化学 来源: 题型:选择题
| A. | c的原子半径是这些元素中最大的 | |
| B. | b与其他三种元素均可形成至少两种二元化合物 | |
| C. | a与其他三种元素形成的二元化合物中其化合价均为+1 | |
| D. | d和a形成的化合物的溶液呈弱酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 g氧气(O2)和32g臭氧(O3)所含氧原子数都为2NA | |
| B. | 18g水中所含电子数为8NA | |
| C. | 常温常压下,1 mol氖气原子数为2NA | |
| D. | 常温常压下,111.2L氮气所含氮原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b>c>d | B. | b>c>d>a | C. | d>a>b>c | D. | a>b>d>c |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
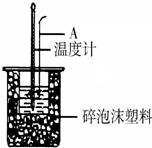 利用如图装置测定中和热的实验步骤如下
利用如图装置测定中和热的实验步骤如下查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极,发生还原反应 | B. | 正极,发生氧化反应 | ||
| C. | 负极,发生氧化反应 | D. | 正极,发生还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com