
【题目】在25℃、101kPa时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)= CH3COOH(l)的焓变为( )
A.-488.3kJ/molB.+488.3kJ/molC.+191kJ/molD.-191kJ/mol
【答案】A
【解析】
25℃、101kPa下,H2(g)、C(s)和CH3COOH(l)的燃烧热分别是285.8kJmol-1、393.5kJmol-1和870.3kJmol-1;则H2(g)+![]() O2(g)=H2O(l)△H=-285.8kJmol-1①,C(s)+O2(g)=CO2(g)△H=-393.5kJmol-1②,CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-870.3kJmol-1③,由盖斯定律可知,①×2+②×2-③可得反应2C(s)+2H2(g)+O2(g)=CH3COOH(1),则此反应的△H =2×(-285.8kJmol-1)+2×(-393.5kJmol-1)+870.3kJmol-1=-488.3KJmol-1,故答案为A。
O2(g)=H2O(l)△H=-285.8kJmol-1①,C(s)+O2(g)=CO2(g)△H=-393.5kJmol-1②,CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-870.3kJmol-1③,由盖斯定律可知,①×2+②×2-③可得反应2C(s)+2H2(g)+O2(g)=CH3COOH(1),则此反应的△H =2×(-285.8kJmol-1)+2×(-393.5kJmol-1)+870.3kJmol-1=-488.3KJmol-1,故答案为A。


科目:高中化学 来源: 题型:
【题目】已知苯与一卤代烷在催化剂作用下可生成苯的同系物:![]() +CH3X→
+CH3X→![]() +HX,在催化剂存在下,由苯和下列各组物质合成乙苯最好应选用的是
+HX,在催化剂存在下,由苯和下列各组物质合成乙苯最好应选用的是
A.CH2=CH2和HClB.CH3CH3和I2
C.CH2=CH2和Cl2D.CH3CH3和HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用下图装置进行实验,K接N,试回答:
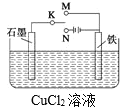
(1)石墨极为______极(填“正”、“负”、“阳” 或“阴”),铁极上的电极反应为:_______。电池总反应为:________。Cu2+向____(填“石墨”或“铁”)电极移动。
(2)若反应过程中有0.1mol的电子发生转移,则铁电极上产生物质的质量为____g,石墨极上产生的物质的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在新型冠状病毒疫情中常用84消毒液进行消毒,有效成分为NaClO溶液,其主要是基于次氯酸(HClO)的氧化性。氯所在的卤族元素在生产生活中有广泛应用,回答以下问题:
(1)基态氯原子的核外价电子排布式为__________,HClO分子中中心原子的杂化轨道类型为__________。
(2)生产农药的原料PSCl3中,P、S、Cl的电负性由大到小的顺序为_________。
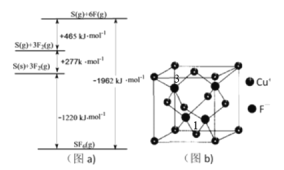
(3)①与Cl相邻的元案S、F,其化化物SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(a)计算相关键能,则S-F键的键能为__________。
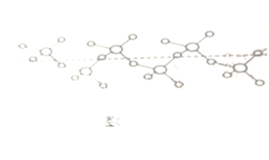
②硫和氧形成的链状化合物结构如图(C),其化学式为__________。
(4)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃。
①CuF的熔点比CuCl的高,原因是_________。
②工业上将CuCl溶入KCN溶液中配制成镀铜液,镀铜液中配合物化学式为__________,写出一种与配体互为等电子体的阳离子的电子式__________。
③CuF晶胞如图(b),晶胞边长为a nm。则Cu+与F-最近的距离为________。用Mg·mol-1表示CuF的摩尔质量,NA表示阿伏加德罗常数的值,则CuF晶体的密度为______g·cm-3。
④以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图(b)中离子1的坐标为(![]() ,
,![]() ,0),则离子3的坐标为__________。
,0),则离子3的坐标为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的是( )
A. 用 所示装置分离CCl4和I2的混合物
所示装置分离CCl4和I2的混合物
B. 用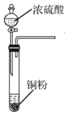 所示装置获取少量SO2气体
所示装置获取少量SO2气体
C. 用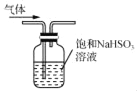 所示装置除去CO2气体中的少量SO2
所示装置除去CO2气体中的少量SO2
D. 用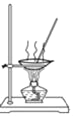 所示装置蒸发NaCl溶液获得NaCl晶体
所示装置蒸发NaCl溶液获得NaCl晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列七种有机物中:
A.CH4 B.CH2=CH2 C.![]()
D.CH3COOH E.淀粉 F.葡萄糖 G.蛋白质
(1)酸性比碳酸强的是______(填字母编号,下同).
(2)易发生银镜反应的是______.(3)具有正四面体结构的是______.
(4)通常用于检验碘单质的是______.(5)可用于合成聚乙烯塑料的是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平.现以A为主要原料合成乙酸乙酯,其合成路线如图1所示.
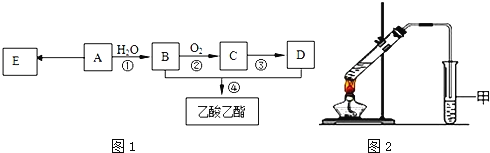
(1)A分子中官能团的名称是______,D中官能团的名称是______;反应①的反应类型是______反应.
(2)反应②的化学方程式是______,反应④的化学方程式是______.
(3)E是常见的高分子材料,合成E的化学方程式是______.
(4)某同学用如图2所示的实验装置制取少量乙酸乙酯.实验结束后,试管甲中上层为透明的、不溶于水的油状液体.
①实验开始时,试管甲中的导管不伸入液面下的目的是______.
②上述实验中饱和碳酸钠溶液的作用是(填字母)______.
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.加速酯的生成,提高其产率
D.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室需要0.5mol·L-1硫酸溶液450mL。根据溶液的配制情况回答下列问题:
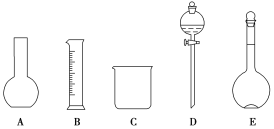
(1)如图所示的仪器中配制溶液肯定不需要的是__(填序号),配制上述溶液还需用到的玻璃仪器是___(填仪器名称)。
(2)现用质量分数为98%、密度为1.84g·cm-3的浓硫酸来配制450mL、0.5mol·L-1的稀硫酸。计算所需浓硫酸的体积为__mL(保留1位小数),现有①10mL ②25mL ③50mL ④100mL四种规格的量筒,你选用的量筒是__(填代号)。
(3)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为:②→①→③→⑧→__→__→__→_(填序号)。__
(4)在配制过程中,下列操作中错误的是__(填代号,下同),其他操作都准确,能引起误差偏高的有__。
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
④定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至刻度线
⑦定容时,俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、铁、镁等元素在生产生活中有广泛的用途,完成下列填空:
Ⅰ钠的重要化合物
(1)在水产养殖上,硫代硫酸钠常用于除去自来水中的氯气,理论上,去除1g的氯气需要0.56g硫代硫酸钠,反应的离子方程式为______。
(2)除去Al2O3中混有的Fe2O3,可将混合物溶于过量的盐酸,再加入Na2CO3调节pH使Fe3+沉淀完全而Al3+不沉淀,用化学用语及相应的离子方程式解释加入Na2CO3的目的______。
Ⅱ铁的重要化合物
(3)磷酸铁(FePO42H2O是难溶于水的米白色固体)可用于生产药物、食品添加剂和锂离子电池的正极材料。实验室可通过下列实验制备磷酸铁。
①称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤,反应加热的目的是______。
②向滤液中加入一定量H2O2氧化Fe2+,为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,在向滴定管中注入K2Cr2O7标准溶液前,滴定管需要检漏、______和______。
③将一定量的Na2HPO4溶液(溶液显碱性)加入到含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO42H2O.若反应得到的FePO4H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为______。
Ⅲ镁的重要化合物
(4)氧化镁和碳粉与氯气在一定条件下反应可制备氯化镁,若尾气可用足量的氢氧化钠溶液完全吸收,则生成的盐为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com