
���� ��1��Ũ���������ˮ�ԣ��ܽ������е�H��O��2��1ˮ����ʽ��ȥ�����ս�����ת��ΪC��
��2��Ũ�����C��Ӧ���ɶ�����̼�����������ˮ��
��3����������Ũ������еĻ�ѧ���ʣ����ͨ�ԡ��������ԣ���������
��4��������ӦCu+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+H2O������n=$\frac{V}{{V}_{m}}$����n��SO2��������ԭ����������SO2��������ԭ���غ���㱻��ԭ�����ᣬ��ϻ�ѧ����ʽ�������ת�����ʵ�����
��� �⣺��1��Ũ���������ˮ�ԣ��ܽ������е�H��O��2��1ˮ����ʽ��ȥ�����ս�����ת��ΪC���������յõ��ĺ�ɫ������C���ʴ�Ϊ��C��
��2��Ũ�����C��Ӧ���ɶ�����̼�����������ˮ���÷�Ӧ��CԪ�ػ��ϼ���0�۱�Ϊ+4�ۡ�SԪ�ػ��ϼ���+6�۱�Ϊ+4�ۣ���Ӧ����ʽΪ2H2SO4��Ũ��+C=CO2��+2SO2��+2H2O���ʴ�Ϊ��2H2SO4��Ũ��+C=CO2��+2SO2��+2H2O��
��3����Ũ���������ˮ�ԣ�Ũ������ˮϡ�Ͷ��ų��������ȣ�Ũ���������ˮ�ԣ���ʹ����̼������ڣ����ɵĺ�ɫ������C��̼��Ũ���ᷢ��������ԭ��Ӧ���ɶ�����̼�Ͷ����������壬����SO2���д̼�����ζ��Ũ����ǿ�����ԣ�
�ʴ�Ϊ���ڢۢܣ�
��4��ͭ��Ũ�����ڼ��ȵ������·�Ӧ��������ͭ�����������ˮ����ѧ����ʽΪ��Cu+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+H2O��n��SO2��=$\frac{13.44L}{22.4L/mol}$=0.6mol�����ݹ�ϵʽSO2��2e-����Ӧ��ת�Ƶĵ���1.2mol������Ϊ���Ժ�ǿ�����ԣ��ʴ�Ϊ��Cu+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+H2O��1.2�����Ժ�ǿ�����ԣ�
���� ������Ҫ������Ũ������������ԣ���Ŀ�Ѷ��еȣ��漰������ԭ��Ӧԭ�������ݻ�ѧ����ʽ�ļ��㣬����ת�Ƶ������ļ������׳�����


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
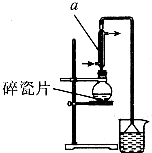 ������±�ᷴӦ���Ʊ�±��������Ҫ������ʵ�����Ʊ�1һ�嶡��ķ�Ӧ��ʵ��װ�����£�
������±�ᷴӦ���Ʊ�±��������Ҫ������ʵ�����Ʊ�1һ�嶡��ķ�Ӧ��ʵ��װ�����£�| �۵�/�� | �е�/�� | �ܶ�/g•cm-3 | |
| ������ | -89.53 | 117.25 | 0.81 |
| 1-�嶡�� | -112.4 | 101.6 | 1.28 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | NaCl | NaHCO3 | NH4Cl |
| 40��ʱ�ܽ��/g | 37 | 13 | 46 |
| 10��ʱ�ܽ��/g | 33 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
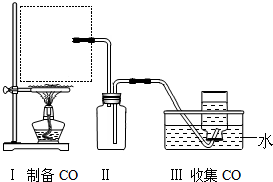
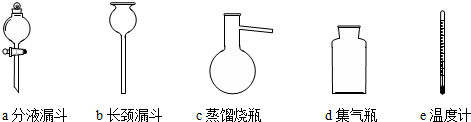

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H+��Fe3+��SO42-��I- | B�� | H+��NH4+��HCO3-��NO3- | ||
| C�� | K+��AlO2-��Cl-��OH- | D�� | Ag+��K+��Cl-��SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
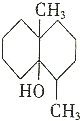 ����ս���ʱ����ˮ��̼������ͷų�һ�ֳ�Ϊ�����صĻ�ѧ���ʣ���ṹ��ʽ��ͼ��ʾ�������Լ����ɼ��ȣ����������ط�Ӧ���ǣ�������
����ս���ʱ����ˮ��̼������ͷų�һ�ֳ�Ϊ�����صĻ�ѧ���ʣ���ṹ��ʽ��ͼ��ʾ�������Լ����ɼ��ȣ����������ط�Ӧ���ǣ�������| A�� | ������ | B�� | �����Ũ����Ļ����Һ | ||
| C�� | ���Ը��������Һ | D�� | ̼������Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
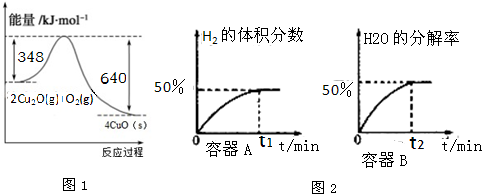
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2A��ˮ��Һ�еĵ��뷽��ʽΪH2A=2H++A2- | |
| B�� | ���¶��£���0.01mol/L��H2A��Һϡ��20������Һ��pH=3 | |
| C�� | �����ͬ��pH��Ϊ1�������H2A��Һ�ֱ���������Zn��Ӧ������H2�϶����H2A | |
| D�� | ��0.1mol/L��H2A��Һ��0.2mol/L�İ�ˮ�������Ϻ���Һ��Ũ������������NH4+ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com