
| A. | 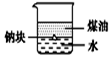 用图装置证明ρ(煤油)<ρ(钠)<ρ(水) | B. | 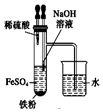 用图装置制备Fe(OH)2 | ||
| C. | 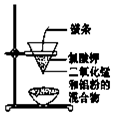 用图装置制取金属锰 | D. | 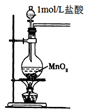 用图装置制取氯气 |
分析 A.钠的密度比水的小,比煤油的大;
B.煤油能隔绝空气,防止生成的氢氧化亚铁被氧化;
C.利用铝热反应可制备熔点高的金属Mn;
D.制取氯气时必须用浓盐酸,稀盐酸不与二氧化锰反应.
解答 解:A.由图可知,钠在水与煤油液面中间,则可知钠的密度比水的小,比煤油的大,故A正确;
B.由图可知,制备氢氧化亚铁应防止被氧化,而煤油能隔绝空气,可防止生成的氢氧化亚铁被氧化,故B正确;
C.由图可知,Al与二氧化锰发生铝热反应生成Mn,故C正确;
D.稀盐酸不与二氧化锰反应,应该选用浓盐酸,图示装置无法达到实验目的,故D错误;
故选D.
点评 本题考查实验方案的评价,明确现象与物质的性质和制取的关系、反应原理及金属冶炼的关系等知识即可解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ClO3-的空间构型为平面三角形 | |
| B. | 乙炔分子中的两个碳原子采用sp2杂化方式 | |
| C. | CS2为V形的极性分子 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 检验FeCl3溶液的Fe2+ | 向溶液中加入酸性KMnO4溶液 |
| B | 比较CH3COOH和HCN的酸性强弱 | 用pH计分别测定CH3COONa、NaCN饱和溶液的pH |
| C | 制备H2SiO3胶体 | 向Na2SiO3溶液中滴加过量HCl |
| D | 除去乙酸乙酯中的CH3COOH | 加入饱和Na2CO3溶液,振荡后静置,分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4g | B. | 11.2g | C. | 5.6g | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
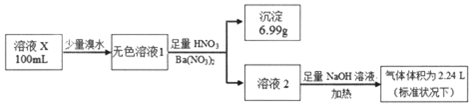
| A. | 溶液X肯定只存在NH4+、SO42- | |
| B. | 溶液X一定不含有Ba2+、Fe3+,可能含有I- | |
| C. | 为确定可能存在的阴离子,可另取试液滴加足量盐酸、BaCl2溶液 | |
| D. | 为确定可能存在的阳离子,可用经过稀硫酸洗过的铂丝蘸取溶液X在酒精灯火焰上灼烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
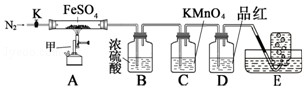
| 实验 | 滴定管 开始读数 | 滴定 终点读数 |
| 1 | 0 | 19.98 |
| 2 | 0.10 | 20.12 |
| 3 | 0 | 20.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)═c(H+)+c( HA-) | B. | c(Na+)═2c(A2-)+2c(HA-) | ||
| C. | c(A2-)+c(HA-)+c(H2A)═0.1mol•L-1 | D. | c(Na+)+c(H+)═c(OH-)+c(HA-)+2c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
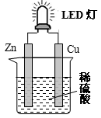
| A. | 铜是负极,电子从铜片经导线流向锌片 | |
| B. | 大多数氢离子在锌片上获得电子被还原 | |
| C. | 装置中存在“化学能→电能→光能”的转换 | |
| D. | 如果将硫酸换成西红柿汁,导线中不会有电子流动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com